高三年级化学质量检测
化 学 试 卷
YCY
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共110分,考试时间60分钟.
可能用到的原子量:H:1 C:12 O:16 Mg:24 Cl:35.5 Fe:56
第I卷
一、选择题:(本题包括8个小题,每小题6分,共48分,每小题仅有一个正确选项)
1.在医院中,为酸中毒病人输液不应采用 ( )
A.0.9的氯化钠溶液 B.0.9的氯化铵溶液
C.1.25碳酸氢钠溶液 D.5%葡萄糖溶液
2.常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液出现红色,该溶液可能是①pH=12的Ba(OH)2 ②pH=12的氨水 ③0.005mol·L-1NaOH
④0.05mol·1-1BaCl2 ( )
A.①② B.③④ C.③④ D.仅④
3.下列物质的溶液,不易氧化、不易分解且能存放在具有磨口玻璃塞的无色试剂瓶中的是
( )
A.醋酸 B.苯酚 C.烧碱 D.硝酸
4.下列叙述正确的是 ( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积,等物质的量浓度的强酸中所含的H+数一定相等
5.常温下,下列各组物质不能用一种试剂通过化学反应区别的是 ( )
A.MnO2 CuO FeO B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3 D.Na2CO3 NaHCO3 K2CO3
6.常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中 ( )
A.C(HCOO-)>C(Na+) B.C(HCOO-)<C(Na+)
C.C(HCOO-)=C(Na+) D.无法确定二者浓度关系
7.能正确表示下列化学反应的离子方程式是 ( )
A.用碳酸钠溶液吸收少量二氧化硫 2CO![]() +SO2+H2O
+SO2+H2O 2HCO![]() +SO
+SO![]()
B.金属铝溶于盐酸中 Al+2H+ Al3++H2↑
C.硫化钠溶于水中 S2-+2H2O H2S↑+2OH-
D.碳酸镁溶于硝酸中 CO![]() +2H+
+2H+ H2O+CO2↑
8.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是 ( )
A.由二氧化碳合成金刚石是化学变化 B.钠被氧化最终生成碳酸钠
C.金刚石中只含有非极性共价键 D.金刚石是碳的一种同位素
第II卷
二、非选择题:(本大题共4题,9题18分,10题14分,11题14分,12题16分,共62分)
9.(18分)现有几组物质的熔点数据如下表:
| A组 | B组 | C组 | D组 |
| 金刚石:3550℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-115℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
据此回答下列问题:
(1)A组属于 晶体,其熔化时克服的微粒间的作用力是 ,在二氧化硅晶体的网状结构中,含有由共价键形成的硅氧原子环,其中最小的环上有
(填数字)个原子;
(2)B组晶体共同的物理性质是 (填序号);
①有金属光泽 ②导电性 ③导热性 ④延展性
|
(4)D组晶体可能具有的性质是 (填序号);
①硬度小 ②水溶液能导电
③固体能导电 ④熔融状态能导电
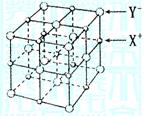
(5)XY晶体的单元结构如图所示,晶体中距离最近的X+
与Y-的核间距离为a cm,已知阿伏加德罗常数为NA
mol-1,其密度为![]() ,则XY的摩尔质量可表示
,则XY的摩尔质量可表示
为
![]()
10.(14分)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L 6.0mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标准状况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,
你如何确定产物中单质的成份 。
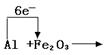
在下面的化学式上标出电子转移的方向和数目
![]() Al+Fe2O3
Al+Fe2O3
(2)②中所发生的各反应的离子方程式是 。
(3)③中所发生的各反应的离子方程式是 。
(4)若实验D的体积仍视为0.15L,则该溶液中C(Mg2+)为 ,
|
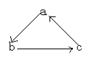
11.(14分)已知a、b、c是中学化学中常见的三种物质,并用具有 的转化关
系。“→”表示在一定条件下,物质转化可经过一步完成(注:①反应条件未给出,如是否加热;②物质的浓稀程度变化属物理变化,可以不计作一步反应。)。
|
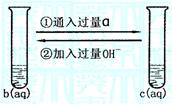
(1)反应情况如图: 已知b物质是侯德榜先生生产的“红
三角”牌并获国际金奖的物质。写出反应的离子方程式:
① ②
|
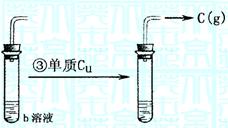
(2)反应情况如图:
已知b物质为常用的强酸,并且可以用铝容器贮存或运输,b物质可选情况较多,请回答以下两种情况及相关问题:
(I)若b物质为 ,则a 、c (以上填写化学式,下同)。
③的化学反应方程式为
(II)若b物质为 ,则a 、c 。
③的化学反应方程式为
12.(16分)A、B、C、D、E属于短周期元素。已知它们都不是稀有气体元素,A的原子半径最大,B元素的原子最外层电子数为m,次层电子数为n,C元素的原子L层电子数为m+n,M层电子数m-n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1。
(1)写出元素符号:A 、B 、C 、D 、E
(2)A和B能以原子数1 : 1形成一种化合物,该化合物的电子式为 。
(3)A和B再分别配上C、D、E以三种元素组成化合物的种类数为 。
(4)仅B分别配上C、D、E以两种元素组成化合物的种类数为 。
高三年级质量检测
化学试卷参考答案
YCY
一、选择题:(本大题共8小题,每小题6分,共48分)
1.B 2.C 3.A 4.B 5.D 6.C 7.A 8.D
二、非选择题:(本大题共4小题,共62分)
9.(18分)(1)原子(2分)共价键(2分) 12(3分) (2)①②③④(3分)
(3)HF 分子间形成氢键,其熔化消耗的能量更多(2分)
(4)②④(3分)
(5)2NAa3ρ(3分)
10.(4分)
(1)A上面加少量KClO3,插上Mg条,并将其点燃。(2分)
用磁铁可检出产物中的单质是否为铁(注:其它合理方法也可)(2分)
|
(2分)
(2)Fe2O3+6H+====2Fe3+++3H2O(1分)
MgO+2H+====Mg2++H2O (1分)
(3)Fe+2H+====Fe2++H2↑ (1分) Fe+2Fe3+====3Fe2+(1分)
(4)0.67mol·L-1(2分) 2.3mol·L-1(2分)
11.(4分)
(1)①CO32-+CO2+H2O====2HCO3-(2分)
②HCO3-+OH-====CO32-+H2O(2分)
(2)(i)H2SO4(1分)SO3(1分) SO2(1分)
Cu+2H2SO4(浓) △ CuSO4+SO2↑+2H2O(2分)
(ii)HNO3(1分) NO2(1分) NO(1分)
3Cu+8HNO3(稀) ==== 3Cu(NO3)2+2NO↑+4H2O(2分)
或b为HNO3 a为NO c为NO2
Cu+4HNO3(浓) ====Cu(NO3)2+2NO2↑+2H2O
12.(16分)
|
(2) (3分)
(3)4 (4分) (4)5 (4分)