高三四月月考理综(化学)试题
6.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解的研究中取得的成果。下列关于蛋白质的说法中不正确的是
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.某些蛋白质跟浓硝酸作用会变黄
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
7.据报道,德国INTEGRAL公司研究出无辐射冷却技术(用水和冰组成的物质代替传统的氟里昂或氨)而荣获德国环境大奖。关于这一“新致冷剂”,以下叙述不正确的是:
A.该致冷剂对环境不产生任何污染
B.该致冷剂的作用原理与氨基本相同
C.该致冷剂在水的凝固点附近的温度下发挥作用
D.该致冷剂具有与水不同的化学性质
8.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是
A.A、B、E一定在不同周期 B. A、D可能在同一主族
C.D为第二周期 D.C、D的单质可能化合为离子化合物
9.某恒温恒容的容器中,建立如下平衡:2A(g)![]() B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
A.都增大 B.都减小
C.前者增大后者减小 D.前者减少后者增大
10.实验室将NaClO3 和Na2SO3 按分子个数比为2∶1倒入烧瓶中,同时滴入适量硫酸,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3 恰好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
11.某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用pH=10的NaOH溶液或pH=10的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
A NaOH溶液的体积大于氨水 B NaOH溶液的体积等于氨水
C NaOH溶液的体积小于氨水 D 无法判断
12.已知电解羧酸盐溶液可得烃类物质,例如:
2CH3COONa
+2H2O![]() CH3CH3↑+ 2CO2↑+ H2↑+ 2NaOH
CH3CH3↑+ 2CO2↑+ H2↑+ 2NaOH
下列判断不正确的是
A.阴极产物是H2和NaOH B.阴极产物是CH3CH3和CO2
C.阳极反应式是2CH3COO--2e-====CH3CH3↑+ 2CO2↑
D.阴极反应式是2H+ +2e-==== H2↑
13..某CuO粉末与适量硫酸(ρ=1.7g·cm-3)在微热下完全反应后,冷却后恰好全部形成CuSO4·5H2O (设反应过程中无水分损失),则此硫酸溶液的物质的量浓度为
A 8.5 mol·L-3 B. 18.4 mol·L-3 C.17 mol·L-3 D. 10 mol·L-3
|
(1)符合条件的A的必要条件是:______________________________
(2)符合条件的分子量最小的有机物A是 (写结构简式)
(3)若A与乙酸分子量相等,则A的结构简式可以是: 。
(4)若A中C、H元素质量分数之和为86.67%,其余为O,A的分子量小于200,则A的分子式为 。 如果A中含苯环结构且能发生银镜反应,符合条件的A的同分异构体有:
27.现有A、B、C、D、E、X、Y和M等物质,它们均为纯净物,在一定条件下,可发生如右图所示的转化,其中X、Y为常见双原子气体单质,其中X为有色气体,B为常见金属单质,质软。E为由两种常见元素(按原子个数1:1)组成的液体,A为黑色化合物,上述各步转化中只写出其中一种生成物,其它生成物没有写出(也有可能反应只有一种生成物)。
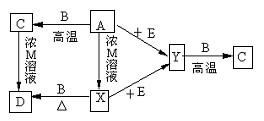 试回答:
试回答:
(1)写出化学式 ,X ,E ;
(2)写出离子方程式:A→X ;
C→D 。
(3)A+E反应的化学方程式为: 。
28..某学生拟用50 mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量时生成NaHCO3,他设计了如下实验步骤:
(a)用25mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(b)小心煮沸所得溶液1min~2min;
(c)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3溶液,用化学方程式说明 。
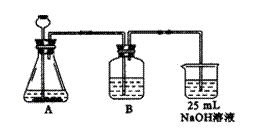 (2)按他的设计,第(a)步实验装置如右图所示。
(2)按他的设计,第(a)步实验装置如右图所示。
①装置A使用的试剂是石灰石和盐酸溶液,可否
使用纯碱代替石灰石,并说明原因
。
②装置B使用的试剂是 ,其作用是 。
③为了便于后续实验的煮沸、混合等操作,装NaOH溶液的容器还可使用 。(填仪器名称)
④有人认为将实验步骤(b)(c)的顺序对调,即先混合再煮沸会更合理,你认为对吗?为什么? 。
(3) 下表所列为有关物质在常温下的溶解度(g/100g水):
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.40 | 35.8 | 35.5 | 20.0 | 40.0 |
根据给出的溶解度数据,若保证在配制过程中不析出晶体,所用NaOH溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
29..某复盐的组成可表示为:![]() ,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
(1)准确称取4.02 g样品加热到失去全部结晶水,冷却后称量,质量为2.94 g.
(2)将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量Ba(NO3)2溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
(3)向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40 g.
请通过计算回答下列问题:
(1)确定R的化学式,R的化学式 ;
(2)求x、y、z的值,x= ,y= ,z= ;
(3)确定A元素,A的相对原子质量是 ,A元素的名称是 ;
(4)该复盐的化学式为 ;
(5)要确定某化合物是否含A元素,最简单方法是 。
一机一中高三四月月考理综(化学)试题参考答案 05.4.22
6 B 7 D 8 C 9 B 10 C 11 A 12 B 13.D
26.(1)氢元素质量分数与乙酸相同(或氢元素质量分数为1/15)
(2) HCHO ;
(3)CO(NH2)2(或HOCH2CHO、HCOOCH3 等 )
(4)C8H8O;
|
![]() CH2 CHO
CHO ( 邻、间、对三种)
CH2 CHO
CHO ( 邻、间、对三种)
27. (1) X Cl2 Y H2O2
|
Al2O3 +6H+=2Al3++3H2O (3) 2H2O2 === 2 H2O +O2↑
28.(1)能;因为NaHCO3+NaOH==Na2CO3+H2O
(2)①不行.粉末纯碱代替块状石灰石,使得生成气体的速度较快,不利于碱充分地吸收CO2。
②饱和NaHCO3溶液 除去CO2中混有的HCl,以避免有NaCl生成影响实验。 ③锥形瓶
④不对 若不先煮沸以赶净CO2,则另一半的NaOH就会与之反应,从而不能完全将NaHCO3转化Na2CO3,实验就失败了。
(3)设每份NaOH溶液中含水100g,根据题意,该溶液中最多只能溶解NaHCO3 8.40g。则参加反应的NaOH的质量为4.0g。
NaOH的质量分数的最大值为3.85%
29..(1)由于向溶液中滴加盐酸,无现象,再滴加![]() 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为![]() (2分)
(2分)
(2)4.02 g样品中含结晶水的物质的量为![]()
4.02 g样品中含硫酸根的物质的量为![]()
![]()
![]()
b+34 18 18
0.58 g (0.58-0.40)g
解得 b=24,∴ B是镁元素
4.02 g样品中含硫酸镁的物质的量为![]()
4.02 g样品中含另一种硫酸盐的物质的量为0.02 mol-0.01 mol=0.01 mol
x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的相对原子质量为![]() ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为![]()
(5)焰色反应