高考化学试题 电化学胶体
1.下列关于胶体的叙述不正确的是
A.布郎运动是较体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来
B.光线透过胶体时,胶体发生丁达尔现象
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
2.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
3.用铂电极(情性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
A.稀NaOH溶液 B.HCl溶液 C.酸性MgSO4溶液 D.酸性AgNO3
4.用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
5.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,基析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
6.以石墨作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极析出铜的质量是
A.8g B.16g C.32g D.64g
7.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e=2Br- ②2Br-—2e=Br2
③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电式的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
8.下列说法正确的是
A.电解NaOH溶液时,溶液浓度将减小,pH增大
B.电解H2SO4溶液时,溶液浓度将增大,pH减小
C.电解Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解NaCl溶液时,溶液浓度将减小,pH不变
9.把淀粉溶液溶于沸水中,制成淀粉胶体。
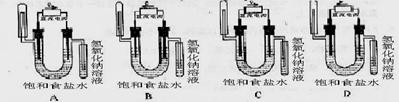
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是 ,该操作的名称是 。
(1)用可见光照射胶体,观察有无“丁达尔现象”,有就是胶体
(2)麦芽糖 渗析
10.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
① 以上反应是可逆反应 ② 以上反应不是可逆反应
③ 充电时化学能转变为电能 ④ 放电时化学能转变为电能
A ①③ B ②④ C ①④ D ②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为
(3)另一种常用的电池是锂电池(很是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电板材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成;电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因
(1)B (2)Ni(OH)2和Cd(OH)2能溶于酸性溶液。(3)锂的摩尔质量小 :2Li+ZH2O→LiOH+H2↑
11.铜片和锌片用导线连接后插入稀硫酸中,锌片是
A.阴极 B.正极 C.阳极 D.负极
12.(2001上海14)氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在l~100nm之间 B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成 D.呈红褐色
13.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2![]() Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是
Cd+2NiO(OH)+2H2O 由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
14.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)︰n(硝酸亚汞)=2︰1,则下列表述正确的是
 A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
A.在两个阴极上得到的银和汞的物质的量之比n(银)︰n(汞)=2︰1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2
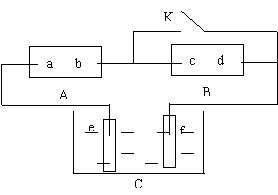
15.右图A为直流电源,B为渗透饱和
氯化钠溶液和酚酞试液的滤纸,C为电镀槽,
接通电路后,发现B 上的 C 点显红色,
请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,
使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或
![]() (只要求填两种电解质溶液)。
(只要求填两种电解质溶液)。
(1)正 (2)2NaCl+2H2O H2↑+Cl2↑+2NaOH
(3)Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液
16.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
17.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
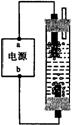 18.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
18.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
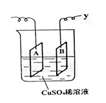 19..下图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为x 、 y。
19..下图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为x 、 y。
(1)当以I=0.21A的电流电解60分钟后,测得铜片A的质量增加了0.25g ,则图中装置的x端应与直流电的 极相连,它是电解池的 极。
(2)电解后铜片B的质量 。(答增加、减少或不变)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
(1)负 ,阴 (2)减少 (3)![]()
![]()
![]()
20.烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物]。下列反应表示整个过程可能发生的变化,其中不符合事实的是
A.2H2O+O2+4e-====4OH- B.Fe====Fe3++3e-
C.Fe2++2OH-====Fe(OH)2 D.4Fe(OH)2+O2+2H2O====4Fe(OH)3
21.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
22.用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
 D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
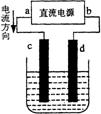
23..右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
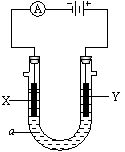 24.()电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
24.()电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是 。在X极附近观察到的现象是 。
②Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
⑴①2H+ +
2e - = H2↑ 放出气体,溶液变红。
②2Cl - - 2e - =
Cl2 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
⑵①纯铜 Cu2+ + 2e - =
Cu
②粗铜Cu - 2e - =
Cu2+
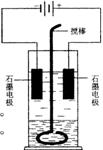 25.
25.
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为_______________________________。
(2)阴极上的电极反应式为________________________________。
(3)原上层液体是________________________________________。
(4)原下层液体是________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是_____________________
_____________________________________________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是______________________________,
现象是_________________________________________________________
____________________________________________________________________________。
(1)2![]() I2 (2)2
I2 (2)2![]() H2↑ (3)KI(或NaI等)水溶液
H2↑ (3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其它合理答案同样给分。例如,若③中答NaI水溶液,这里答火焰呈黄色。)
26.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A. a电极是负极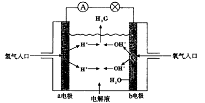
B. b电极的电极反应为:4OH--4e-=2H2O +O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
27.(2004广东11)PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaoH B.H2SO4 C.AgNO3 D.Na2SO4
28.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
29.氢氧化铁胶体稳定存在的主要原因是
A.胶粒直径小于1nm B.胶粒作布朗运动 C.胶粒带正电荷 D.胶粒不能通过半透膜
30.(2004上海13)下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( D )