高三化学电解质溶液 胶体
例1:体积为1升,氢离子浓度为0.01mol·L-1盐酸和醋酸,分别与同量的金属锌反应时,哪种酸反应速率快?哪种酸与锌反应放出H2多?
【分析】:①这两个反应的本质相同,都是酸电离出的H+与zn反应产生H2,反应速率的大小取决于溶中H+浓度的大小,而题目给出二者电离出的[H+]相同,因而反应速率相同。
②反应放出H2的多少,取决于酸中可电离的H+总数(包括已电离的H+和没电离的H+)。对于同是一元酸的盐酸和醋酸来说,这实际是取决于其物质的量的大小。
盐酸是一元强酸,H+浓度与盐酸的浓度相同都为0.01mol·L-1则盐酸与足量的锌反应放出的H2的量为![]() 醋酸在此条件下,电离度约为1%,其溶液浓度约为
醋酸在此条件下,电离度约为1%,其溶液浓度约为![]() 其溶液中存在电离平衡,反应消耗掉一部分H+,又可以通过平衡加以补充,直到所有的醋酸全部反应,其产生的H2的量为
其溶液中存在电离平衡,反应消耗掉一部分H+,又可以通过平衡加以补充,直到所有的醋酸全部反应,其产生的H2的量为![]()
【答案】①反应速率相同②醋酸产生H2多。
【总结】:要注意强弱电解质的含义及对电离度概念的透彻分析。
例2:比较下列化学反应后所得溶液中各离子浓度的大小。
①10ml的0.2mol·L-1的HCl与10ml的0.2mol·L-1氢水混和所得溶液中各离子浓度由大到小的顺序是 。
②10ml的0.4mol·L-1的CH3COONa溶液与10ml的0.2mol·L-1的HCl溶液混合后,所得溶液中各离子浓度由大到小的顺序是
【分析】①盐酸可以与氨水发生反应
HCl+NH3·H2O=NH4Cl+H2O
而题中所溶HCl与NH3·H2O物质的量相同恰好完全反应,相当于所给NH4Cl溶液。发生如下反应:
NH4Cl=NH4++Cl-;NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
因为部分NH4+水解而消耗所以[Cl-]>[NH4+]。
又因为水解的NH4+仅占全部极少部分,因而生成的H+也很小,导致[NH4+]>[H+]
而且NH4Cl为强酸弱碱盐,溶液显酸性,因而[H+]>[OH-]
②CH3COONa+HCl=NaCl+CH3COOH ,
反应中醋酸钠是过量的,反应所得的溶液为各是0.1mol/L的NaCl、CH3COONa、CH3COOH的混和物。
CH3COONa=CH3COO-+Na+
NaCl=Na++Cl-
CH3COOH![]() CH3COO-+H+
CH3COO-+H+
因而[Na+]最大,由于除CH3COONa之外,CH3COOH也电离出少量的CH3COO-,导致[CH3COO-]>[Cl-];由于溶液中存在大量CH3COOH,所以溶液显酸性[H+]>[OH-],CH3COOH为弱电解质,电离出的[H+]极少,小于[Cl-]的浓度。
【答案】①[Cl-]>[NH4+]>[H+]>[OH-]
②[Na+]>[CH3COO-]>[Cl-]>[H+]>[OH-]
【总结】:当在同一种溶液中放入若干种物质,且物质之间能发生反应生成弱电解质,这时我们在分析离子浓度时可让各物质去尽情反应,认为起始投料即为产物,再写出电离及水解方程式进行分析。
电离及水解的程度很少,我们可以用1%来估计。
【例3】:把FeCl3溶液蒸干灼烧,最后得到的主要的固体产物是什么?若将Fe2(SO4)溶液蒸干灼烧,最后的主固体产物又是什么?在FeCl3溶液中加入Na2S及Na2CO3溶液时所得产物有哪些?写出有关的化学方程式或离方程式。
【分析】:FeCl3为强酸弱碱盐,能发生水解反应。
FeCl3+3H2O![]() Fe(OH)3+3HCl -Q
Fe(OH)3+3HCl -Q
升温时,平衡向右移动;而蒸干又会使HCl挥发,变为气体逸出,使该反应非常充分。而Fe(OH)3受热分解为Al2O3。
②Fe2(SO4)3也有如下水解反应
Fe2(SO4)3+6H2O![]() 2Fe(OH)3+3H2SO4 -Q
2Fe(OH)3+3H2SO4 -Q
因为H2SO4是难挥发性酸,在蒸干过程中不断浓缩,又反应回去,因而固体为Fe2(SO4)3。
③FeCl3与Na2CO3遇上,其中Fe3+将与CO32-发生彻底的双水解。
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
FeCl3与Na2S接触,发生的则是氧化还原反应。
2Fe3++S2-=2Fe2++S↓
【答案】产物①Al2O3 ②Fe2(SO4)3 ③Fe(OH)3及CO2、FeCl2及S。
方程式①FeCl3+3H2O![]() Fe(OH)3+3HCl,2Fe(OH)3
Fe(OH)3+3HCl,2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
②Fe2(SO4)3+6H2O![]() 2Fe(OH)3+3H2SO4
2Fe(OH)3+3H2SO4
③2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
2Fe3++S2-=2Fe2++S↓
【例4】将80mlNaOH溶液加入到120ml的HCl中,所得溶液的PH值为2,若选用的NaOH溶液及HCl浓度相同,求其物质的量浓度。
【解析】
设混和前的氢氧化钠及盐酸的物质的量浓度为xmol/L
①混和溶液PH值为2,则其中[H+]=o.o1mol/L.
②![]()
【例5】向碳酸钠溶液中逐滴加入稀HCl直到不再生成CO2气体为止,则在此过程中,溶液中的HCO3-浓度的变化趋势可能是 试用方程式说明
【分析】:本题是对二元弱酸根离子浓度随外加氢离子浓度变化规律的考查。
首先Na2CO3电离:Na2CO3=2Na++CO32-
加入H+之后,分步反应:H++CO32-=HCO3-此时HCO3-浓度逐渐增大。当全部的CO32-都转化为HCO3-之后,再加入H+,则H++HCO3-=H2O+CO2↑,随着该反应的发生,
HCO3-的浓度又逐渐降低。
〈例1〉:将PH=8与PH=10的NaOH溶液等体积混合后溶液的PH值最接近于( )
(A) 8.3 (B) 8.7 ( C) 9 (D) 9.7
【分析】:本题中混合后的溶液为碱性,因而用[OH-]的浓度进行计算。
设两种NaOH溶液各为1升
则![]()
(计算中,10-6与10-4比起来相差很小,可忽略不计,水电离出的OH-同理可被忽略)。
得![]() 则PH≈9.7
则PH≈9.7
错解:两溶液中[H+]的浓度分别为10-8mol·L-1及10-10mol·L-1
∴![]() ∵
∵![]()
症结所在:按[H+]进行计算是错误的,在碱溶液中[OH-]很大。故可不计由水电离的 [OH-]。但此时[H+]很少,忽略水电离产生的[H+]会造成误差,第二种解法忽略了水的电离,错误。
【答案】D
〈总结〉:混合后溶液显碱性,按[OH-]浓度求算;混合后溶液显酸性,则先求[H+]混,再求溶液PH值。
〈例2〉从有关资料中可查得,工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。清回答下列问题。
①两极发生反应的电极反应式。
②写出Cr2O72-变为Cr3+的离子方程式。
③工业废水由酸性变为碱性的原因是什么?
④能否改用石墨电极?原因是什么?
【分析】本题目给出了工业处理含Cr废水的信息,属信息题类型,要求从题目中获取足够的信息。从而解决该问题。除Cr2O72-的方法是先将其还原为Cr3+;再得Cr3+在碱性条件下转化为Cr(OH)3,将Cr2O72-还原的方法,我们能够想到两种:其一是Cr2O72-直接从电极获得电子而被还原可是我们发现Cr2O72-带负电,在溶液中只能移向阳极,在阳极上获得电子是不太可能的。因而我们将希望寄托于第二种方法:Fe电极被氧化而产生的Fe2+,从而得出正确的解答。
【答案】①阳极Fe-2e=Fe2+
阴极2H++2e=H2↑
②Cr2O72-在H+存在的条件将Fe2+氧化为Fe3+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
③H+不断放电, Cr2O72-与Fe2+反应中消耗H+都导致水的电离平衡被坏,使[OH-]>[H+]
④不能,用石墨作电极,阳极将产生Cl2,得不到Fe2+,无还原剂,无法将Cr2O72-变为Cr(OH)3而除去。
〈例3〉 :在硫化钠溶液中存在多种离子和分子,下列关系正确的是
(A)[Na+]>[S2-]>[OH-]>[HS-]
(B)[OH-]=2[HS-]+[H+]+[H2S]
(C)[OH-]=[HS-]+[H+]+2[H2S]
(D)[Na+]+[H+]=[OH-]+[HS-]+[S2-]
【分析】:在Na2S溶液中存在着下列电离及水解方程式。
Na2S=2Na++S2-
S2-+H2O![]() OH-+HS-
OH-+HS-
HS-+H2O![]() H2S+OH-
H2S+OH-
因为水解程度很小,所以产生的[HS-]<[S2-]
则有[Na+]>[S2-]>[OH-]>[HS-]
根据溶液为中性,我们可列出溶液中的电荷守恒方程式:
溶液所带正负电荷总数相同
[Na+]+[H+]=[OH-]+[HS-]+[S2-]……①
无论各种离子以什么形式存在,整个溶液中Na元素原子数目与硫元素原子个数必为2:1则
[Na+]=2([S2-]+[H2S]=[HS-])……②
上述①②两方程式联立,消去[Na+]可得出第三大关系式:
[H+]+[HS-]+2[H2S]=[OH-]……③
第③个关系式亦可以如下方法得到:
溶液中有H+的得与失,得到的H+的总物质的量必与失去的H+的总物质的量相同。
得到H+的物质有:游离H+本身,HS-(S2-+H+),H2S(S2-+2H+)因而用2[H2S]才能代表S2-得到的H+总数;失去H+的微粒只有OH-。可列③式.③式变可称为质子(即H+)守恒。
【答案】A、C
【总结】熟练掌握溶液中三大守恒──电荷守恒、元素守恒、质子守恒是解决溶液中微粒数目问题的有力武器。
〈例4〉
已知反应AsO43-+2I-+2H+![]() AsO33-+I+H2O是可逆反应。现设计如图的实验装置,进行下述操作。
AsO33-+I+H2O是可逆反应。现设计如图的实验装置,进行下述操作。
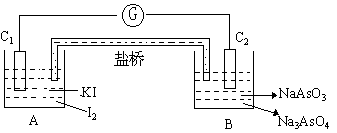
①向B烧杯中逐渐加浓HCl,发现微安表偏转。
②若改向B烧杯中滴加40%的NaOH溶液,发现微安表向前述相反的方向偏转。
问①两次操作过程中指针发生偏转的原因是
②两次操作过程中指针偏转方向相反,用化学平衡移动原理解释为
〈分析〉:
①图中的盐挢,是一个起导电作用的装置,其作用是将两个烧怀A和B联系起来。盐挢的导电是通过离子进行,不同于金属导电,金属是通过电子导电。盐桥导电时,A与B为一个整体,是一个原电池,而金属导电,AB则是两个装置。
②在B中加入HCl,相当于将整个反应中加入HCl,使总反应正向移动。每个烧怀中发生了部分氧化还原反应,形成原电池,产生电流。
在B中加入NaOH,相当于在总反应体系中加入NaOH,使平衡向逆反应方向移动,因而形成原电池电流方向向反。
实际上,酸碱只对B烧怀中的电板反应有影响,A烧怀中反应与H+及OH-浓度无关。所以将酸碱加入B烧怀与加入整个体系中等效。
〈解答〉
①该实际条件将化学能转化为电能
②由于[H+]的改变,使化学平衡向不同方向移动,表现上产生不同方向的反应。
③2I──2e=I2
④ASO33-+H2O-2e=ASO43-+2H+