高三化学复习氯碱工业
班级:_________ 姓名:_________
一、选择题(每小题2分,共20分。每小题有1~2个正确答案)
1.用铂作电极,电解500mLKCl溶液,当两极产生气体的总体积为16.8mL(标准状况)时,溶液的pH范围为
A.8~10 B.10~12 C.5~6 D.3~4
2.有水存在时氯化锂受热可发生水解。现将某氯化锂溶液蒸干并熔融后用铂电极进行电解,下列有关电极产物的判断正确的是
A.阳极产物是氢气 B.阳极产物有氧气
C.阴极产物有锂和氢气 D.阳极产物只有氯气
3.下图装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法中正确的是
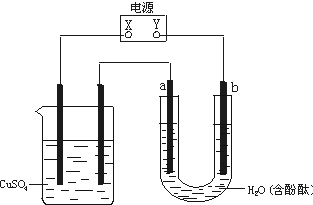
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的pH逐渐减小
D.CuSO4溶液的pH保持不变
4.1LK2SO4、CuSO4的混合溶液中,c(SO![]() )=2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到(标准状况下)22.4L气体,则原溶液中c(K+)为
)=2mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到(标准状况下)22.4L气体,则原溶液中c(K+)为
A.0.5mol·L-1 B.1mol·L-1
C.1.5mol·L-1 D.2mol·L-1
5.在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④③①
6.铁棒和石墨棒用导线连接后,浸入0.01mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出O2 D.石墨棒上放出Cl2
7.电解溶质质量分数为26.0%的饱和食盐水100g,通入0.200mol电子后溶液中NaOH的质量分数的理论值是
A.8.02% B.8.00% C.8.63% D.8.61%
8.家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物,通电时,发生器内电解槽里的极板上产生大量气泡。切断电源后所得消毒液具有强烈的杀菌能力,跟发生器直接有关的反应是
A.2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.H2+Cl2===2HCl
C.Cl2+2NaOH===NaCl+NaClO+H2O
D.NaClO+HCl===NaCl+HClO
9.将含有0.400molCu(NO3)2和0.400molKCl的水溶液1L,用惰性电极电解一段时间后,在一个电极上析出0.300molCu,此时在另一电极上放出的气体在标准状况下的体积为
A.3.36L B.6.72L
C.5.60L D.大于5.60L,小于6.72L
10.用惰性电极电解未精制的饱和食盐水,食盐水装在U型管内。结果很快在某一电极附近出现食盐水浑浊现象。造成浑浊的难溶物主要是
A.碳酸镁 B.硫酸钡
C.氢氧化镁 D.碳酸钡
二、填空题(22分)
11.下图是用石墨和铁作电极电解饱和食盐水的装置。请填空:
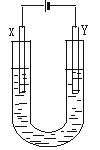
(1)X的电极名称是___________极,发生的电极反应式为___________,Y极的电极材料是___________。检验X极的产物方法是___________。
(2)某同学在实验时误将两种电极材料接反,导致X极上未收到预期产物。一段时间后又将两极的连接方式纠正过来,发现X一端出现了白色沉淀,此沉淀是___________(填化学式)。其形成原因是___________,该沉淀在空气中放置,现象是______________________。
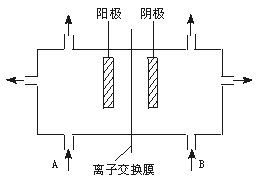
(3)工业上电解饱和食盐水的方法之一,是将两个极室用离子交换膜隔开(如下图)其目的是___________,阳极室(A处)加入___________,阴极室(B处)加入___________,离子交换膜只许___________离子通过。
三、计算题(8分)
12.20℃时食盐的溶解度为36g,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出11.2L(标准状况)气体时,食盐完全电解,所得溶液密度为1.20g/mL,试计算
(1)电解时,饱和食盐水的质量;
(2)电解后溶液中NaOH的物质的量浓度;
(3)要使溶液恢复原状态,需加入多少克什么物质?
参考答案
一、1.B 2.B 3.AC 4.D 5.C 6.B 7.C 8.AC 9.C 10.C
二、11.(1)阳 2Cl--2e-===Cl2↑ Fe 用湿润的淀粉碘化钾试纸放在管口,若变蓝,说明有Cl2产生
(2)Fe(OH)2 铁作阳极时被氧化为Fe2+,纠正后,这一端又变为阴极,2H++2e-===H2↑,生成的OH-与Fe2+结合成Fe(OH)2 先变灰绿色,后变红褐色
(3)防止H2与Cl2混合爆炸,防止Cl2与NaOH生成NaClO使NaOH不纯 饱和食盐水 纯水(或NaOH稀溶液) Na+
三、12.(1)221g (2)5.4mol·L-1 (3)通入36.5gHCl气体