高三综合测试卷(化学部分卷)
6.下列离子中,电子数大于质子数且质子数大于中子数的是 ( )
A. D3O+ B. Li+ C. OD- D. OH- (05上海化学.18)
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
( )
A. 放电时负极反应为:Zn-2e-+2OH- =Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH- =FeO42-+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 (05江苏化学.14)
D. 放电时正极附近溶液的碱性增强
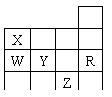 8.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是(05北京.8)
( )
8.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是(05北京.8)
( )
A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
9.碘元素有多种价态,可以形成多种含氧阴离子![]() 。由2个
。由2个![]() 正八面体共用一个面形成的
正八面体共用一个面形成的![]() 的化学式为
( )
的化学式为
( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() (05广东化学.4)
(05广东化学.4)
10.对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是 ( )
4NO(g)+6H2O(g),下列叙述正确的是 ( )
A. 达到化学平衡时,4![]() 正(O2)=5
正(O2)=5![]() 逆(NO) (05广东化学.17)
逆(NO) (05广东化学.17)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是:2![]() 正(NH3)=3
正(NH3)=3![]() 正(H2O
)
正(H2O
)
11.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为 ( )
A. 1∶7 B. 1∶9 C. 1∶5 D. 2∶9 (05江苏化学.17)
12..下列叙述正确的是 ( )
A. 反应Na2O2+2HCl=2NaCl+H2O2为氧化还原反应 (05天津.11)
B. 反应:HOCH2-![]() -CH(OH)CH2COOH+HBr
-CH(OH)CH2COOH+HBr![]()
BrCH2-![]() -CH=CHCOOH+2H2O 仅涉及消去反应类型
-CH=CHCOOH+2H2O 仅涉及消去反应类型
C. 10 mL 0.02 mol / L AgNO3溶液与10 mL 0.02 mol / L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D. 10 mL 0.04 mol / L HCl溶液与10 mL 0.02 mol / L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
13.下列离子方程式正确的是 ( )
A. 硫酸氢钠溶液中加入盐酸 ![]() +2H+ ® CO2+2H2O (05上海化学.13)
+2H+ ® CO2+2H2O (05上海化学.13)
B. 硫化亚铁与盐酸反应 S2-+2H+ ® H2S
C. 苯酚钠溶于醋酸溶液 C6H5O-+CH3COOH ® C6H5OH+CH3COO-
D. 氯化亚铁溶液中通入少量氯气 Fe2++Cl2 ® Fe3++2Cl-
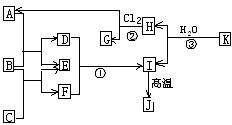
26(Ⅰ).(10分)右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)
 请按要求回答:
请按要求回答:
(1) 写出B的化学式__________________,G的电子式______________________。
(2)反应①的离子方程式_____________。
(3)反应②进行的条件是______________、____________。 (05江苏化学.22)
(4)反应③的化学方程式为____________________________________。
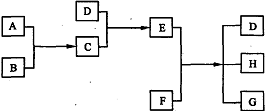 (Ⅱ).(8分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(Ⅱ).(8分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(1)D的化学式(分子式)是 ,E的化学式(分子式)是 。
(2)A和B反应生成C的化学方程式是 。
(3)E和F反应生成D、H和G的化学方程式是 。
27.(12分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。 (05北京.26)
(1)A可以发生的反应有 (选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子所含官能团的名称是 、 。
(3)B分子中没有支链,其结构简式是 ,B的具有相同官能团的同分异构体的结构简式是 。
(4)由B制取A的化学方程式是 。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
| B |
| C |
| 天门冬氨酸 |
天门冬氨酸的结构简式是 。
28.(14分)海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。 (05广东大综合.35)
(1) 海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2) 目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3) 工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ® NaOH+H2+Cl2(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。(可能需要的相对原子质量:Na 23 Cl 35.5
H 1 O 16)
(4) 近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
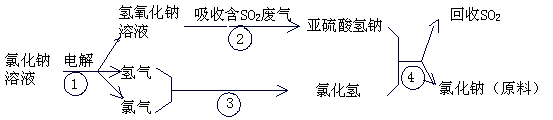
请写出②④的化学反应方程式: 、 。
(5) 上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A. 皂化反应 B. 聚合反应 C. 与金属钠反应 D. 氧化反应
29.(16分)
钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(FeTiO3)制取TiO2的流程如下: (05广东化学.22)
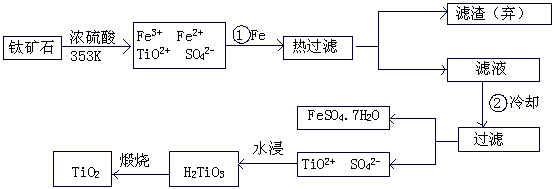
(1) Ti的原子序数为22,Ti位于元素周期表中第 周期,第 族。
(2) 步骤①加Fe的目的是 ;
步骤②冷却的目的是 。
(3) 上述制备TiO2的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
(4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为:
![]()
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
反应TiCl4+2Mg=2MgCl+Ti 在Ar气氛中进行的理由是 。
DCDAAACC
26 (1)Al;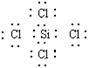
(2)Al3++3AlO2—+6H2O=4Al(OH)3↓ (3)光照; 过量Cl2
(4)Al4C3+12H2O=4Al(OH)3+3CH4↑
解析:可从H、G是正四面体结构的非极性分子,H与Cl2反应得G考虑,知H是CH4,G是CCl4。由B是金属,能与A、C这两种常见化工原料反应得到同一物质E,且所生成的另一物质D和F能反应生成一种高温能分解的物质,可知B应是Al。推出的物质应是:
A:HCl B:Al C:NaOH D:AlCl3 E:H2 F:NaAlO2 G:CCl4
H:CH4 I:Al(OH)3 J:Al2O2 K:Al4C3
26 (1)NH3; NH4Cl
(2)H2+Cl2![]() 2HCl
2HCl
(3)2NH4Cl+Ca(OH)2![]() 2NH3↑+2H2O+CaCl2 (05MCE1.26)
2NH3↑+2H2O+CaCl2 (05MCE1.26)
27. (1)①③④
(2)碳碳双键,羧基
(3)HO—![]() —CH=CH—
—CH=CH—![]() —OH; CH2=C(COOH)2
—OH; CH2=C(COOH)2
(4)HO—![]() —CH=CH—
—CH=CH—![]() —OH+2CH3OH
—OH+2CH3OH![]()
CH3O—![]() —CH=CH—
—CH=CH—![]() —OCH3+2H2O
—OCH3+2H2O
(5)HO—![]() —CH2—
—CH2—![]()
![]() —OH
—OH
28. (1) ⅠA (2) 物理变化 (3) NaCl;585 t
(4) NaOH+SO2=NaHSO3; NaHSO3+HCl=NaCl+H2O+SO2 (5) C、D
。
29. (16分)
(1) 4; ⅣB
(2) 将Fe3+还原为Fe2+; 析出(或分离、或得到)FeSO4·7H2O
(3) FeSO4·7H2O; 石灰(或碳酸钙、废碱)
(4) -80 kJ·mol-1 ; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用