高中三年级化学教学质量监测(三)
理科综合—化学部分
可能用到的相对原子质量:N-14;O-16;Ca-40;Cl-35.5;H-1;C-12;
一、选择题
6.2006年诺贝尔化学奖授予美国科学家Roger.D.Kormberg,他揭示了真核生物体内的细胞如何利用基因内存储的信息生产蛋白质。下列关于蛋白质的说法中正确的是
A.蛋白质、淀粉、油脂均为天然有机高分子化合物
B.蛋白质均易溶于水,均能跟浓硝酸作用变黄
C.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
D.可以采用多次盐析的方法分离提纯蛋白质
7.下列对有关化学反应过程或实验现象的解释正确的是
A.Cl2的水溶液可以导电,说明Cl2是电解质
B.在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si
C.向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后,溶液褪色,说明BaCl2溶液有酸性
8.下列可逆反应达到平衡时,增大压强和升高温度使平衡移动方向相同的是
A.NH4HCO3(s)![]() NH3(g)+H2O(l)+CO2(g);⊿H>0
NH3(g)+H2O(l)+CO2(g);⊿H>0
B.2NO(g)![]() N2O4(g);
⊿H<0
N2O4(g);
⊿H<0
C.Cl2(g)+H2O(g)![]() HCl(g)+HClO(aq);⊿H>0
HCl(g)+HClO(aq);⊿H>0
D.2SO2(g)+O2(g)![]() 2SO3(g);
⊿H<0
2SO3(g);
⊿H<0
9.下列有关叙述正确的是
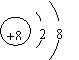 . A.在CCl4和CH4中各原子最外层均能达到8个电子的稳定结构
. A.在CCl4和CH4中各原子最外层均能达到8个电子的稳定结构
B.在MgO晶体中,O2-的结构示意图可表示为
C.13C与14C互为同素异形体
D.NH3是非极性分子,而CO2是极性分子
10.用铂作电极电解下列溶液时,在阴极上有金属析出,且溶液的pH下降的是
A.KNO3 B.CuSO4 C.NaOH D.HCl
11.由CaCl2和盐酸组成的混合溶液500mL中,已知c(Ca2+)=0.3mol/L,c(Cl-)=1.6mol/L,溶液密度约为1.10g/cm3,则下列判断正确的是:①该溶液的pH=1;②该溶液中c(OH-)=1×10-14;③该溶液中含有Ca2+物质的量为0.15mol;④ Ca2+的质量分数为5.0%。
A.①③④ B.②③ C.②③④ D.①③
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和
B.常温常压下,1molNO2气体与水反应生成NA个NO3-离子
C.1mol C3H8所含的共用电子对数为10NA
D.92gNO2和N2O4混合气体中含有的分子数目为1.5NA
13.下列反应的离子方程式书写正确的是
A.实验室用大理石与醋酸反应制取二氧化碳 CaCO3+2H+=Ca2++CO2↑+H2O
B.向过氧化钠固体中滴加水 Na2O2+H2O =2Na++2OH-+O2↑
C.将溶质物质的量之比为4∶3的 NaHSO4和 Ba(OH)2两溶液混合
4H++3SO42-+3Ba2++4OH-=3BaSO4↓+4H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液
Fe2++2H++H2O2=Fe3++2H2O
二、主观题
26.(15分)现有七种短周期元素A~G的有关性质的数据如下:
| 元素编号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 | 0.077 | 0.071 |
| 主要化合价 | +2 | +3 | +6 -2 | +2 | —2 | +4 -4 | -1 |
(1)五种元素中非金属性最强的是 (填元素符号),C、E形成化合物为_______(填化学式)
(2)单质A与F的最高价氧化物反应的化学方程式为____________________________________
(3)E、F、G的氢化物沸点由高到低的顺序是____________________________(用分子式表示)
(4)证明B元素与A元素在性质上有明显不同的离子方程式为______________________________
27.(15分)下图各物质是中学化学中常见的物质,F、G为重要的化工原料,I为混合物具有漂白性,,甲、乙、丙、丁、戊、已常温下为气体,反应①是实验室制取甲的反应。 C为淡黄色固体。有关转化关系如下图
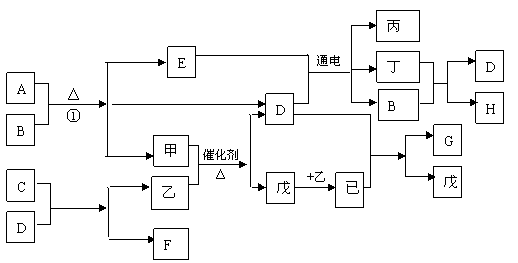

请回答下列问题:
(1) 写出C的电子式 ,甲分子的结构式为
(2) 写出反应①的化学方程式
(3) 写出丁和F反应的离子方程式
(4) 6 g丙与足量的乙恰好反应,生成常温下为液态的产物并放出857.4kJ热量,请写出该物质燃烧热的热化学方程式 。
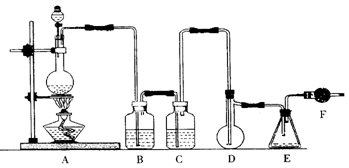 |
28.(15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题
(1)装置A中发生反应的化学方程式为 。
(2)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(3)实验时,D装置需加热至50—59℃.最好采用 方式加热。如何防止E中液体挥发 。
(4)F装置中干燥管内所盛物质的作用是 。
(5)二氯化硫电子式为 。
29.(15分)
现有A~F六种化合物,有关它们的信息如下。①、②中有一反应是与Br2的CCl4溶液的加成反应。1molF在碱性条件下水解生成1molG和1molH。G为油脂的水解产物。
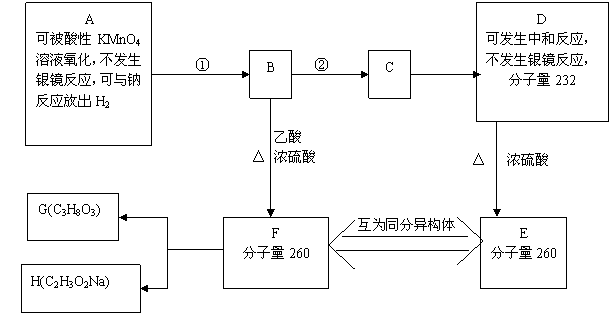
 请回答下列问题
请回答下列问题
(1)与Br2的CCl4溶液发生加成反应的是__________ (填反应编号①或②)
(2)D中含有的官能团有________________
(3)A的结构简式为________________;E的结构简式为________________
(4)写出F在碱性条件下水解的化学方程式
_________________________________________________________________________________
答 案 及 评 分 标 准
一、选择题
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | C | C | B | B | B | C | C |
二、非选择题
26.(15分) 点燃
(1)F;(3分) SO2、SO3;(3分) (2)2Mg+CO2=2MgO+C;(3分)
(3)H2O>HF>CH4;(3分)
(4)Al(OH)3+OH-=AlO2-+2H2O;(3分,写Al2O3或Al与NaOH溶液的离子方程式也给分)
27.(15分) H
‥ ‥ ︳
(1)Na+[﹕O﹕O﹕]2-Na+;(3分) H-N-H;(3分)
|
(2)2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O;(3分)
(3)Cl2+2OH-=Cl-+ClO-+H2O;(3分)
(4)H2(g)+![]() O2(g)=H2O(l);⊿H=-285.8kJ/mol (3分)
O2(g)=H2O(l);⊿H=-285.8kJ/mol (3分)
|
(1)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O (2分) (2)增大反应接触面 (3分)
(3)水浴;(2分) 将锥形瓶放人冰水中冷却(2分)
(4)防止空气中水蒸气进入E中并吸收残留的氯气。(3分)
(5)
![]() (3分)
(3分)
29.(15分) (1)①;(3分) (2)羧基、溴原子;(3分,写结构简式也给分)
(3)A:CH2=CHCH2OH;(3分) E:CH2BrCHBrCOOCH2CH3;(3分)
(4)CH3COOCH2CHBrCH2Br+3NaOH → CH3COONa+CH2OHCHOHCH2OH+2NaBr (3分)