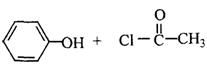高三化学自测试试题
6. 下列说法正确的是
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都是从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的
7.继科学家发现C![]() O
O![]() 是金星大气成分之后,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C
是金星大气成分之后,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质。已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C![]() O
O![]() 与硫化羰的说法中不正确的是
与硫化羰的说法中不正确的是
A.C![]() O
O![]() 与CO一样可以在氧气中燃烧生成CO
与CO一样可以在氧气中燃烧生成CO![]()
B.CO、C![]() O
O![]() 、CO
、CO![]() 都是碳的氧化物,它们互为同素异形体
都是碳的氧化物,它们互为同素异形体
C.COS是由极性键构成的极性分子,分子中所有原子都满足8电子稳定结构
D.硫化羰在氧气中完全燃烧后的生成物是CO![]() 和SO
和SO![]()
8.设阿伏加德常数为NA。则下列说法正确的是
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
9. TCL集团将于2006年全面采用钛金属技术。单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
①FeTiO3+3H2SO4 Ti(SO4)2+ FeSO4+3H2O
|
|
![]() ④TiO2+2C+2Cl2 TiCl4↑+2CO↑
④TiO2+2C+2Cl2 TiCl4↑+2CO↑
⑤TiCl4+2Mg=2MgCl2+Ti
下列叙述错误的是
A.反应①是非氧化还原反应 B. 反应②是水解反应
C.反应④中TiO2是氧化剂 C. 反应⑤是置换反应
10.下列离子方程式书写正确的是
A.NaClO溶液中通入少量二氧化硫:SO2+H2O+ClO-=SO42-+Cl-+2H+
B.碳酸氢钙溶液跟氢氧化钠溶液混合:HCO![]() +OH-=CO
+OH-=CO![]() +H2O
+H2O
C.金属钠加入水中:Na+H2O=Na++OH-+H2↑
D.苯酚钠溶液与氯化铝溶液反应:C6H5O—+Al3++3H2O=C6H5OH+Al(OH)3↓
11.当前燃料电池发展迅速。固体氧化物燃料电池是由美国西屋(Westinghouse)公司研
制开发的。它以固体氧化锆一氧化钇为电解质,这种固体
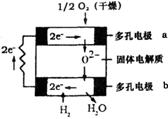 电解质在高温下允许氧离子(O2-)在其间通过。该电池的工
电解质在高温下允许氧离子(O2-)在其间通过。该电池的工
作原理如图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-=4OH-
D.该电池的总反应方程式为:2H2+O2=2H2O
12.在容积1升的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:(1)2A(g) ![]() 2B(g)+C(g);(2)A(g)
2B(g)+C(g);(2)A(g) ![]() C(g)+D(g)。当达到平衡时,测得c(A)=2.5
mol·L-1,c(C)=2.0 mol·L-1。则下列说法中正确的是
C(g)+D(g)。当达到平衡时,测得c(A)=2.5
mol·L-1,c(C)=2.0 mol·L-1。则下列说法中正确的是
A.达到平衡时A的总转化率为40% B.达到平衡时c(B)为1.0 mol·L-1
C.达到平衡时c(B)=2c(D) D.达到平衡时c(D)=2c(B)
13.已知1mol白磷转化为红磷时放出18.39kJ的热量,在下列两个反应中:
P4(白·s)+5O2(g)=2P2O5(s);ΔH=-akJ/mol(a>0)
4P(红·s)+5O2(g)=2P2O5(s);ΔH=-bkJ/mol(b>0)
a和b的关系是
A.a<b B.a=b C.a>b D.无法确定
26.(12分)A、B、C、D、E几种常见的化合物或单质之间有如下转化关系:
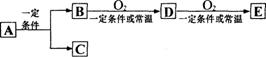 |
(1)若E是酸酐,D是有刺激性气味的无色气体,则B的化学式是 ,工业上实现D转化为E的化工设备的名称是 。
(2)若C是酸性气体,B是碱性气体,则E是 。工业生产实际中。合成B选择一定的下列条件的依据是:
①压强
②温度
(3)若A是日常生活中最常见的物质,C为黄绿色单质气体,则E的电子式为 。
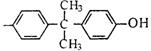
(4)若A是某有机物,其分子空间构型为正四面体,写出下列反应的化学方程式:
A→B+C ;
B→D 。
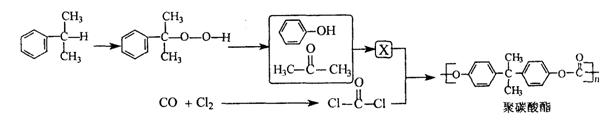
27.(17分)2005年10月12日,“神舟六号”发射成功。宇航员费俊龙、聂海胜佩戴头盔的盔壳由聚碳酸酯制成,具有隔音、隔热、防碰撞、减震性好、质量小等特点。已知:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有
![]() O
O
很好的反应活性,易跟某些含羰基的化合物R—C—R′(R、R′代表烷基或H原子)
|
 |
下图是合成聚碳酸酯的过程(反应条件和部分产物未写出):
|
请写出:
(1)X的结构简式 。
![]() O
O
(2)在一定条件下X与Cl—C—Cl 反应合成聚碳酸酯的化学方程式
。
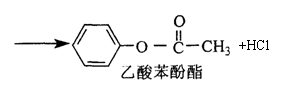
(3)X和浓溴水反应时,1molX最多能消耗Br2 mol。
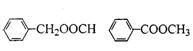
(4)与乙酸苯酚酯分子式相同,分子中含有苯环且属于酯的其他可能的结构简式
。
28.(本题15分) 下图是一个制取氯气并以氯气为原料进行特定反应的装置。
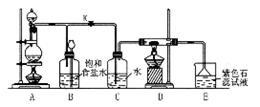 (1)A是氯气发生装置,其中发生反应的化学方程式为___________________________。
(1)A是氯气发生装置,其中发生反应的化学方程式为___________________________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯,连接上E装置。Cl2通过C瓶后进入D,D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中发生反应的化学方程式_________________,装置C的作用是____________________________。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____________。
(4)若将E处烧杯中的溶液改为澄清石灰水,反应过程中的现象为___________(选填序号)。
A.有白色沉淀生成 B.无明显现象 C.首先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是_______________________,B的作用是________________________。
29.(12分)据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知![]() 溶沸点较低,易升华。回答下列问题:
溶沸点较低,易升华。回答下列问题:
(1)写出Be与![]() 反应生成
反应生成![]() 离子方程式_________________。
离子方程式_________________。
(2)![]() 与
与![]() 可用________试剂鉴别,其离子反应方程式为____________________________
可用________试剂鉴别,其离子反应方程式为____________________________
(3)![]() 是________(填写离子化合物或共价化合物)。
是________(填写离子化合物或共价化合物)。
(4)Li和Mg据对角线规则,性质也相似。则Li在空气中燃烧主要产物是_________;同时还有少量__________生成。
6.D 7.B 8.C 9.C 10.A 11.D 12.B 13.C
|
2C+O2(不足) 2CO
27.(17分)(1)(3分)
|
|
|
![]() nHO
+nCl—C—Cl
+2nHCl
nHO
+nCl—C—Cl
+2nHCl
(3)(3分)4
(4)(8分,每少一个结构简式扣2分,但不得负分)
| 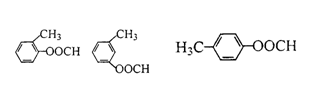 | |||
28. [答案](1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。(2)2Cl2+C+2H2O
MnCl2+Cl2↑+2H2O。(2)2Cl2+C+2H2O![]() CO2+4HCl,提供水蒸气。(3)HCl溶于水呈酸性使石蕊试液变红色,部分氯气溶于水生成强氧化性的HClO,使石蕊试液褪色。(4)B。(5)溶液进入漏斗;贮存氯气。
CO2+4HCl,提供水蒸气。(3)HCl溶于水呈酸性使石蕊试液变红色,部分氯气溶于水生成强氧化性的HClO,使石蕊试液褪色。(4)B。(5)溶液进入漏斗;贮存氯气。
29.(12分
(1 Be+20H-=BeO22-+H2↑
(2) _![]() __
__ ![]() +OH-_==BeO22-_+H2O_
+OH-_==BeO22-_+H2O_
(3)共价
(4)Li2O Li3N