高三级化学12月考试题
总分100分
第1卷
一、选择题(共8个小题,每小题只有一个正确答案,每小题6分,共48分)
1、某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是( )
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
2、 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是 ( )
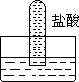
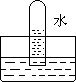

A B C D
3、下列操作错误的是( )
A.玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上
B.若要除去CO2中少量SO2,可通过盛有饱和NaHCO3溶液的洗气瓶
C.在实验室中使用金属钠时若不慎着火,可立即用细沙灭火
D.配制0.1mol/L的H2SO4溶液时,量取浓硫酸小心注入盛有少量蒸馏水的容量瓶中
4、76.8mg铜和适量浓硝酸反应,铜全部溶解后,如果NO3-离子减少
2×10-3 mol,则溶液中H+同时下降( )。
A.2×10-3 mol B.3.2×10-3 mol
C.4.4×10-3 mol D. 4×10-3 mol
5、下列各选项所述的两个量,前者一定大于后者的是
①F![]() 和Br
和Br![]() 的沸点 ②NH3和PH3的沸点
的沸点 ②NH3和PH3的沸点
③二氧化碳和二氧化硅的熔沸点
④25℃时,pH都等于3的硝酸和硫酸溶液中,H+的浓度
⑤氮气和氨气通常状况下在水中的溶解度
⑥SO3和SO2的熔点 ⑦H![]() 和H
和H![]() 的离子半径
的离子半径
⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
6、从下列事实所列出的相应结论正确的是
| 实 验 事 实 | 结 论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | Na2SiO3溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>H2SiO3 |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
7、下列反应的离子方程式正确的是
①硫酸铜溶液与氢氧化钡溶液反应: Ba2++ SO42_= BaSO4↓
②将金属钠加入水中 2Na + 2H2O = 2Na+ + 2OH - + H2 ↑
③石灰石溶于硝酸:CaCO3+2H+== Ca2++CO2↑+H2O
④氯气与KI溶液反应: CI2+2I-=CI-+I2
⑤小苏打溶液中加入少量的石灰水:Ca2+ +2OH-+2HCO3-=CaCO3↓+CO32- +2H2O
![]() ⑥Cu和浓硫酸共热:Cu+SO42- +4H+=== Cu2+
+SO2↑ +2H2O
⑥Cu和浓硫酸共热:Cu+SO42- +4H+=== Cu2+
+SO2↑ +2H2O
⑦钠化硫溶液和稀硝酸溶液反应:S2- +2H+ =2H2S↑
⑧氯气与水反应Cl2 + H2O = 2H+ + Cl - + ClO-
⑨纯碱溶液中滴加少量盐酸CO32- + H+ = HCO3-
A.①②⑤⑨ B.②③⑤⑨ C.④⑤⑥⑦ D.②③⑧⑨
8、下列反应的离子方程式正确的是
A.用铂作电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.硫氢化钠水解:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C.硫酸氢钾溶液与过量Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+==BaSO4↓+H2O
D.向过量氨水中滴加少量氯化铝溶液:Al3++4OH-==AlO2-+2H2O
第11卷(共52分)
9、( 10 分)麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由NH4NO3在微热条件下分解产生,产物除N2O外还有一种,写出此反应的化学方程式: 。(2分)生成1molN2O时反应中转移的电子数为 mol。(1分)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物质——光气(COCl2):
2CHCl3+O2=2HCl+2COCl2,写出光气的电子式: 。(1分)为了防止发生事故,使用前要先检验氯仿是否变质,写出检验所用的试剂 。(2分)
(3)锡在元素周期表中位于第 周期、第 族,砷的原子序数为 。(3分)
(4)氙的化学性质不活泼,但它的确可在一定条件下生成化合物。现取1mol氙气和3.5mol氟气于密闭容器中,后来余下了0.5mol氟气同时有白色固体形成,此白色固体的化学式为 。(1分)
10、(13分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,A与C、B与D分别是同一主族元素,且B2— 与C+具有相同的电子层结构。请回答下列问题:
(1)写出元素符号:A B C D 。(4分)
(2)CA与A2B反应有单质A生成的化学方程式为: 。(1分)
(3)一定条件下,DB2气体与足量的B单质充分反应生成40g气态化合物,放出
49.15 kJ热量,其热化学方程式为 ;(2分)(写出工业上DB2
气体与足量的B单质反应的条件 。(2分)
(4)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则N极是该电池的 极;(2分)M极的电极反应式为:__________________ 。(2分)
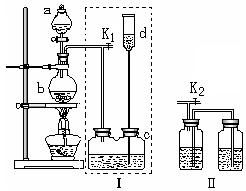 11、(13分)某学校化学研究性学习小组
11、(13分)某学校化学研究性学习小组
在制取某些有毒气体并进行性质实验时,
为了防止毒气造成大气污染而设计了图
(Ⅰ)装置,并打算用图(Ⅱ)装置代
替图(Ⅰ)中的虚线部分以求达到同样
的目的。
(1)仪器a的名称为 ,
仪器b的名称为 。(每空1分,共2分)
(2)若用装置(Ⅰ)制取氯气,这时装置b中发生反应的化学方程式为 ,(2分)c瓶中的液体一般为 。(2分)在选取试剂正确且适量的前提下关闭K1活塞后,反应开始,发现d中液面上升并不明显,可能的原因是 ,(2分)检查此原因的简单方法是
(2分)
(3)装置(Ⅰ)虚线部分能防止多余气体逸散的原因是 。(2分)
(4)用装置(Ⅱ)代替装置(Ⅰ)中的虚线部分,你认为可行吗? ,原因是
。(3分)
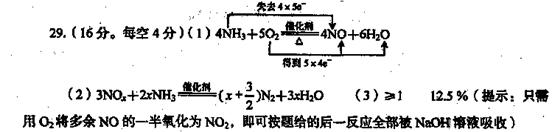
12、 (15分)工业上用氨氧化法制硝酸,尾气中氮的氧化物(NO、NO2)是主要的大气污染物之一。
(1)写出氨催化氧化反应的化学方程式,并标出反应中电子转移的方向和数目。
(4分)
(2)用NOx表示氮氧化物,若用氨催化还原法治理硝酸工业的尾气,该反应的化学方程式为 (4分)
(3)NaOH,吸收法治理硝酸工业尾气的反应原理如下:
2NO2+2NaOH=NaN03+NaN02+H20,NO+NO2+2NaOH=2NaN02+H20
尾气中的N02和NO能够被NaOH溶液完全吸收时,![]() 的取值范围是
,(3分)
的取值范围是
,(3分)
当尾气中:![]() =
=![]() 时,要保证尾气被NaOH溶液完全吸收,至少需要向尾气中加
时,要保证尾气被NaOH溶液完全吸收,至少需要向尾气中加
O2的体积占N02和NO总体积的 %(同温同压下)。(4分)
高三级化学12月考试题答卷
班级 姓名 学号
可能用到的原子量:Cu:64
第1卷(共48分)
选择题:(共8个小题,每小题6分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
第11卷(共52分)
9、( 13 分)。
(1)写出此反应的化学方程式: 。(2分)生成1molN2O时反应中转移的电子数为 mol。(1分)
(2)写出光气的电子式: 。(1分)检验所用的试剂 。(2分)
(3)锡位于第 周期、第 族,砷的原子序数为 。(3分)
(4)此白色固体的化学式为 。(1分)
10、(16分)
(1)写出元素符号:A B C D 。(4分)
(2)CA与A2B反应有单质A生成的化学方程式为: 。(1分)
(3其热化学方程式为 ;(2分)(写出工业上DB2
气体与足量的B单质反应的条件 。(2分)
(4)N极是该电池的 极;(2分)M极的电极反应式为:__________________ 。(2分)
11、(15分)
(1)仪器a的名称为 ,仪器b的名称为 。(每空1分,共2分)
(2)若用装置(Ⅰ)制取氯气,这时装置b中发生反应的化学方程式为 ,(2分)c瓶中的液体一般为 。(2分)可能的原因是 ,(2分)检查此原因的简单方法是
(2分)
(3)装置(Ⅰ)虚线部分能防止多余气体逸散的原因是 。(2分)
(4)用装置(Ⅱ)代替装置(Ⅰ)中的虚线部分,你认为可行吗? ,原因是
。(3分)
12、 (15分) (1)写出氨催化氧化反应的化学方程式,并标出反应中电子转移的方向和数目。
(4分)
(2)用NOx表示氮氧化物,若用氨催化还原法治理硝酸工业的尾气,该反应的化学方程式为 (4分)
(3) ![]() 的取值范围是
,(3分)
至少需要向尾气中加
的取值范围是
,(3分)
至少需要向尾气中加
O2的体积占N02和NO总体积的 %(同温同压下)。(4分)
答案:1、C 2.C 3. D 4.C 5.C 6.C 7.B 8.C
9. 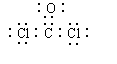 (1)NH4NO3
(1)NH4NO3![]() N2O↑+2H2O 4
N2O↑+2H2O 4
(2) AgNO3
(3)五 IVA 33
(4)XeF6
10.(15分)(1)H O Na S (2)NaH +H2O = NaOH+H2↑
(3)SO2(g)+ 1/2O2(g)==== SO3(g); △H =-98.3 kJ/mol ;400~500,催化剂
(4)正极 ; H2 + 2OH—-2e- = 2H2O
![]()
|
(2)MnO2+4HCl(浓)====MnCl2+Cl2 +2H2O;饱和食盐水;装置的气密性不好;关闭分液漏斗的活塞和K1,往d中加水,能在d中形成水柱并保持液面不下降,说明气密性良好(或用湿润的淀粉碘化钾试纸检查各连接处)。
(3)多余的气体储存在c瓶中;
(4)不行;右瓶没有出气口,左瓶中的水无法压入右瓶。