高三理综测试化学部分第二次模拟试题
理科综合试题(化学部分)
以下数据可供解题时参考:
原子量:H – 1 C – 12 N – 14 O – 16 Na – 23 Mg – 24 Al – 27 S – 32
Cl – 35.5 Cu – 64 Fe – 56 Ag – 108 I – 127
一、选择题(本题包括13小题,每题只有一个选项符合题意,每题6分)
6.下列说法正确的是 ( )
A.BaSO4难溶于水,是弱电解质
B.福尔马林、漂白粉、胆矾、纯碱都是混合物
C.石炭酸沾到皮肤上,先用酒精清洗,再用大量水冲洗
D.所有的金属氧化物都是碱性氧化物
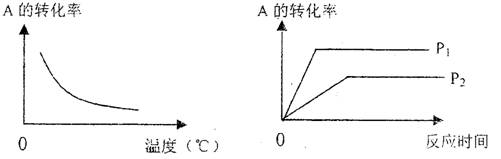
![]() 7.可逆反应mA(g) +
nB(g) xC(g)在不同温度及压强(P1、P2)条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是 ( )
7.可逆反应mA(g) +
nB(g) xC(g)在不同温度及压强(P1、P2)条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是 ( )
|
A.△H > 0,m + n < x B.△H > 0,m + n > x
C.△H < 0,m + n > x D.△H < 0,m + n < x
8.在一定条件下,下列粒子的还原性顺序为:Cl-< Br-<Fe2+ <I < SO2,由此判断以下各应的溶液中不能发生的是 ( )
A.2Fe3+ + SO2 + 2H2O = 2Fe2+ +SO42-+ 4H+
B.2Br-+ 4H+ + SO42- = SO2 + Br2 + 2H2O
C.2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
D.I2 + SO2 + 2H2O = 4H+ + SO42-+ 2I-
9.下列各组物质中,能发生不同化学反应的是 ( )
①C与O2 ②P与Cl2 ③Fe与Cl2 ④Na与O2 ⑤CO2与NaOH溶液
⑥Cu与硝酸 ⑦AgNO3溶液与氨水 ⑧AlCl3I溶液与氨水 ⑨乙醇与浓H2SO4
A.除⑨外 B.除③⑧外 C.除②⑦外 D.除⑥⑦⑧外
|
|
①瓶内盛满水,用来贮存难溶于水的气体
②瓶内盛有一定量的液体试剂,用来除去某气体中的杂质气体
③瓶内无液体,收集密度比空气小的某些气体
④瓶内贮存难溶于水的气体,加水时气体从中排出
A.①③ B.②④
C.①②③④ D.②③④
11.2006年5月15日,国家食品药品监督管理局查处通报了齐齐哈尔第二制药有限公司使用工业溶剂二甘醇(HO—CH2CH2—O—CH2CH2—OH)代替药用溶剂丙二醇(HO—CH2CH2—OH)生产“亮菌甲素注射液”,目前已经造成4人死亡,6人重症病人正在接受治疗的严重后果。下列关于二甘醇的说法正确的是 ( )
A.二甘醇和丙二醇性质完全相同
B.二甘醇和丙二醇互为同系物
C.二甘醇分子间可形成氢键,沸点较高
D.二甘醇是一种有机溶剂,不溶于水
12.下列叙述中正确的是 ( )
A.IA族元素的金属性比ⅡA族元素的金属性强
B.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
C.在零族元素的单质晶体中,即有共价键又有分子间作用力
D.ⅦA族元素的氢化物中,稳定性最好的物质其沸点也最高
13.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F2和Br2的沸点
②纯水在25℃和80℃时的pH
③25℃时,等体积的pH都为3的盐酸和AlCl3溶液中,水的电离程度
④H-和H+的离子半径
A.①②③ B.②③④ C.①③ D.②④
26.(1)(10分)化学物质及性质与某些工业生产的原理及设备密切相关。请回答下列问题:
①通信光缆的主要成分是
②NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中,其原因是(用化学方程式表示)
③生产普通硅酸盐玻璃用到的主要原料是(写名称)
④工业用接触法制硫酸的主要设备依次为 、 、
(2)(4分)下列叙述或操作不正确的是
①金属镁着火时,可用二氧化碳来灭火
②苯酚与少量的溴水能生成三溴苯酚白色沉淀
③配制银氨溶液时,是在氨水中逐滴加入AgNO3溶液至沉淀恰好消失为止
④氯水通常保存在棕色广口瓶中
27.(15分)A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种元素的原子序数之和是E的原子序数的2倍。B是形成化合物种类最多的元素,E的阳离子与D的阴离子都比A的阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。回答下列问题:
(1)D在周期表中位于第 周期,第 族。
(2)B、C、D三种元素原子半径由大到小的顺序是(用相应的元素符号表示)
(3)写出由D、E两种元素形成的固体属于 晶体(填晶体类型名称)。
(4)写出含D质量分数最高的氢化物的电子式 。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是 ,推测该化合物可能具有的性质 (至少写出三种)。
(6)写出E最高价氧化物对应水化物与过量B的最高价氧化物反应的离子方程式
。
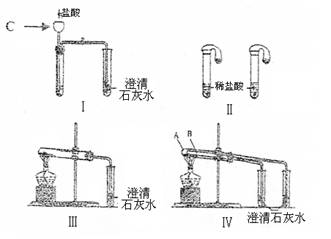
|
(1)仪器C的名称是 ,只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号) 。
(2)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式) 。
(3)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号) 。
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到用一套装置同时进行两个对比实验,Ⅲ不行
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液溶质的化学式为 ,请设计实验检验所得溶液中溶质的阴离子 。
(Ⅱ)(6分)2005年6月中国新华网报道“雀巢”奶粉被列入碘超标食品。根据国家卫生部规定,婴幼儿食品碘的含量为259μg/kg——680μg/kg,根据生活经验和以上说明回答下列问题:
(1)“雀巢”奶粉中碘元素以 (填“游离态”或“化合态”)存在。
(2)某学生为了测定奶粉中碘元素的质量分数(不考虑奶粉中的其他添加成分)设计了以下实验步骤:
a.称取Wg奶粉溶于水,充分搅拌,将混合液置于半透膜袋内,并将半透膜袋浸入蒸馏水中,经过一段时间,蒸馏水中主要有 离子存在,此操作称为 。b.向蒸馏水中继续滴加足量的硝酸银溶液,产生黄色沉淀,过滤、洗涤、干燥,称量所得固体质量为ag。
c.计算奶粉中碘元素的质量分数为 。
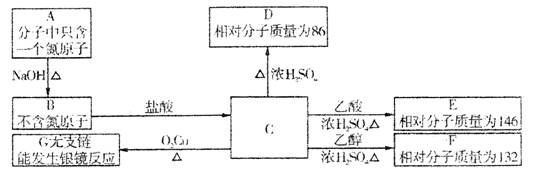
|
(1)C的摩尔质量是 ,在一定条件下有机物C可能发生的化学反应的类型有(填序号) 。
a.水解反应 b.取代反应 c.加成反应 d.消去反应 e.加聚反应
(2)分别写出A、D、G的结构简式 。
(3)C→E的化学方程式 。
(4)写出所有的除C外且与C具有相同官能团且不带支链的同分异构体的结构简式
。
参考答案
6.C 7.C 8.B 9.B 10.A 11.C
|
26.(1)(10分)①SiO2 2分 ②2NaOH + SiO2 = Na2SiO3 + H2O 2分
③石灰石、纯碱、石英 各1分 ④沸腾炉、接触室、吸收塔 各1分
(2)(4分)①②③④ 每个1分
27.(15分)(1)二 VIA族 各1分
(2)C > N > O 2分 (3)离子 2分
|
(4) 2分
(5)乙二酸或草酸 2分 酸性、不稳定性、还原性 各1分(其他合理答案也给分)
(6)OH + CO2 = HCO3 2分
28.(I)(10分)(1)长颈漏斗 1分 II 1分
(2)NaHCO3 1分
(3)D 1分
(4)①Ca2+ + OH + HCO3 = CaCO3↓+ H2O 2分 ②Na2CO3 1分
取上层清液,滴加BaCl2溶液,若产生白色沉淀,说明有CO32 3分
(II)(1)化合态 1分
(2)I
1分 渗析 2分 ![]() ×100%
2分
×100%
2分
29.(15分)
(1)104g/mol 2分 b d 2分
(2)A:HOCH2CH2CH2COONH4 2分
D: CH2 = CHCH2COOH 2分 G:HOOCCH2CH2CHO 2分
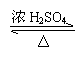 |
(3)HOCH2CH2CH2COOH + CH3COOH CH3COOCH2CH2CH2COOH + H2O
3分
![]()
![]() (4)CH3CHCH2COOH
CH3CH2CHCOOH 各1分
(4)CH3CHCH2COOH
CH3CH2CHCOOH 各1分