高三化学三月月考
第一卷(选择题 共64分)
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Si 28 S 32
Cl 35.5 Fe 56 Cu 64
一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只是一个选项符合题意)
1.中秋佳节,雪月饼倍受青睐,为防止冰激凌融化,在携带的过程用干冰作制冷剂,某市民回家后将干
冰放在密封的塑料瓶中,并保存在冰箱里。下列说法中正确的是…( )
A.可增强冰箱的制冷效果,是节能的好方法
B.冰箱内温度低,便于干冰的保存,以利重复使用
C.干冰易与冰箱内的食物发生化学反应,会影响食物的营养价值
D.干冰易升华,放在密封的瓶中因体积澎涨,会引发冰箱爆炸。
2.依据物质的相关数据,可以推断物质的结构和性质。下列利用物质的相关数据作出的相应推断不合理
的是
A.依据元素的原子序数,推断该元素原子的核外电子数
B.依据物质相对分子质量,推断物质熔、沸点的高低
C.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性
3.为提纯下列物质(括号内为含少量的杂质),选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 硝酸钾(NH4NO3) | 水 | 结晶 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 甲烷(C2H4) | 溴水 | 洗气 |
| D | 苯(C6H5OH) | 浓溴水 | 分液 |
4.某溶液含有较多的Na2SO4和少量的Fe2 (SO4)3若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4
溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤.正确的操作步骤是( )
A.②⑥③ B.④⑥①③ C.④⑥③⑤ D.②⑥①③⑤
5.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是
 |
A.人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘单质。
B.该食盐商品是以海盐为原料,经人加工后的产品,是盐类的纯净物。
C.1 kg此食盐中含碘酸钾(35±15) mg。
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定。
6.下列离子方程式表示正确的是
A.AgNO3 溶液中加入Cu : Cu+Ag+=Cu2++Ag
B.NaHCO3溶液中加入CH3COOH: CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.0.1mol FeBr2 溶液中通入足量Cl2 : 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
7.咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄色污渍变为红色,经水漂洗后又变为黄色。据此现象,你认为咖喱汁与下面何种试剂可能有相似的化学作用?( )
A.品红溶液 B.石蕊溶液 C.氯水 D.KI-淀粉溶液
8.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是
先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS ……………………①
Sb4O6+6C=4Sb+6CO ………………………………②
关于反应①、反应②的说法正确的是
A. 反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3 mol FeS时,共转移6 mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.NA代表阿伏加德罗常数的值,下列叙述不合理的是
A.常温常压下,22.4 L N2所含的分子数小于NA
B.在含有1mol CH3COO-的醋酸钠溶液中, Na+数目略大于NA
C.8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
D.0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA
10.某含有Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。将
该溶液进行如下实验:①滴加足量的新制氯水,有气泡生成,溶液变黄色;②向“①”中所得溶液中加入
BaCl2溶液,无沉淀生成;③向“①”中所得溶液中加入淀粉溶液,不显蓝色。依据上述实验事实推断该
溶液
A.一定存在Fe2+、Br-、CO32- B.一定呈碱性 C.一定不存在I-、SO32- D.可能存在NH4+
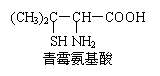 11.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示
11.青霉素是医学上一种常用的抗生素,在体内经酸性水解后,得到青霉氨基酸,其结构简式如右图所示
(分子中的-SH与—OH具有类似性质)。
下列关于青霉氨基酸的推断合理的是
A.青霉氨基酸分子中所有碳原子均在同一直线上
B.青霉氨基酸具有两性并能发生酯化反应
C.青霉氨基酸分子间能形成多肽
D.1mol青霉氨基酸与足量的金属钠反应生成0.5mol H2
12.某种只含铁和氧两元素的样品A.在高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸
收,得沉淀的质量是原样品A质量的50/29 倍,由此得出的结论,其中正确的是( )
①A可能不含Fe3O4; ②A一定不含FeO
③A一定是由一种或二种物质组成 ④A可能由一种、二种或三种物质混合物
A.①③ B.①④ C.①② D.②③
13.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(Ac—)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液2c(H+)+c(HA)=c(A-)+2c(OH-)
14.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:
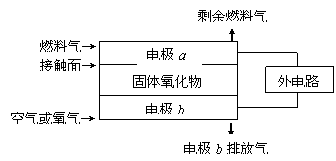 |
下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
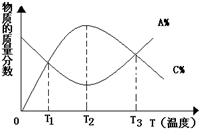 15.已知可逆反应:aA+bB
15.已知可逆反应:aA+bB ![]() cC,物质的质量分数A%和C%随温度的变化曲线如右下图所示,下
cC,物质的质量分数A%和C%随温度的变化曲线如右下图所示,下
列说法正确的是
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是吸热反应
D.升高温度,平衡向正反应方向移动
16.二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存
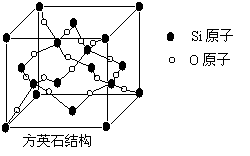 在于石英矿中。除石英外,SiO2还有鳞石英和方英石等多种变
在于石英矿中。除石英外,SiO2还有鳞石英和方英石等多种变
体。方英石结构和金刚石相似,其结构单元如下图:
下列有关说法正确的是
A.方英石晶体中存在着SiO4结构单元
B.1molSi原子形成2molSi-O键
C.上图所示的结构单元中实际占有18个Si原子
D.方英石晶体中,Si-O键之间的夹角为90°
第二卷(非选择题 共86分)
注意:将第17、18题的答案均填在答案卷上
三、(本题包括2小题,共22分)
17.(10分)某兴趣小组学生通过思考,准备完成下列实验
Ⅰ、将混有铜粉的氯化铁晶体(FeCl3·6H2O)提纯,以得到纯净的氯化铁晶体,有人提出了下列实验步骤:a、把样品溶解;b、过滤除去铜粉; c、蒸干溶液即得氯化铁晶体
你认为以上是否步骤可行? 其原因是 (请写出必要的文字说明和有关的反应方程式)
Ⅱ、该兴趣小组同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证
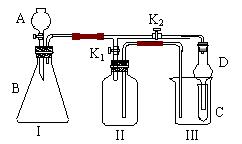 物质的性质。
物质的性质。
⑴ 打开K1关闭K2,可制取 气体。
⑵ 打开K2关闭K1,能比较一些物质的性质。
甲同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是 ;仪器D在该装置中的作用是 。
乙同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是 。
18.(12分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所
示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
![]()
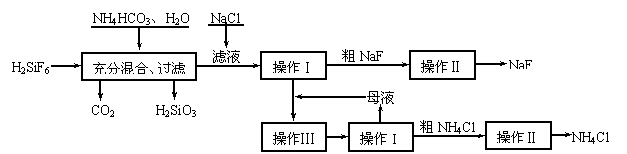
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
⑴ 上述流程中发生两步化学反应,第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
⑵ 操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶ 操作II的作用是 。
⑷ 操作Ⅲ的具体过程是 。
⑸ 流程中NH4HCO3必须过量,其原因是 。
高三化学三月月考答题卷
选择题一、二
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
四、(本题包括2小题,共18分)
17、Ⅰ 、
Ⅱ(1)
(2)现象是 ;作用是 。
实验目的是 。
18、⑴第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
⑵ 操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶ 操作II的作用是 。
⑷ 操作Ⅲ的具体过程是 。
⑸ 流程中NH4HCO3必须过量,其原因是 。
五、(本题包括2小题,共18分)
19.(8分)下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(数据单位相同)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部数据。
| (H) 13.6 | (He) 24.6 54.4 | ||||||
| (Li) 5.4 75.6 122.5 | (Be) 9.3 18.2 153.9 217.7 | (B) 8.3 25.2 37.9 259.4 340.2 | (C) 11.3 24.4 47.9 64.5 392.1 489.9 | (N) 14.5 29.6 47.4 72.5 97.9 552.1 …… | (O) 13.6 35.1 …… …… …… …… …… | (F) 17.4 34.9 …… …… …… …… …… | (Ne) 21.6 41.6 …… …… …… …… …… |
⑴每组数据可能是该元素的 。
A.原子得到电子所放出的能量 B.单质在不同条件下的熔、沸点
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径大小
⑵稀有气体元素的第一个数据较大的原因是__________________________________;请你推测镁和铝的第一个数据的大小Mg_____Al。
⑶同一元素原子的一组数据中,有的数据增大特别多,形成突跃,这些数据出现的规律,说明原子结构中 。
20.(10分)由短周期元素组成的10种物质A~J间有下图所示的转化关系。已知A、B为同周期相邻元
素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反
应生成D和F;J在光照时有I生成,E的式量比D大16。试回答:
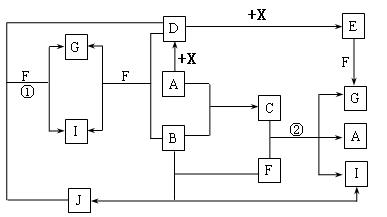
⑴工业生产中实现“D→E”转化的设备是 。
⑵反应①的离子方程式为 。
⑶足量铁与G的热的浓溶液反应所得气体是 。
⑷在一定条件下,9g液态F吸收49gE气体生成液态G时放出热量65.15kJ,则表示该反应的热化学方程式为 。
⑸C是一种重要的化工产品,为易挥发樱桃红色液体。若反应②中G和A的物质的量之比为1∶2,则C的电子式为 。
六、(本题包括1小题,共10分)
21.(10分)碱式氯化铝[Al2(OH)nCl6-n]m (1≤n≤6,m≤10) (商业代号BAC),是一种比Al2(SO4)3效果更好的净水药剂。以下是用煤矸石(主要含Al2O3,SiO2及少量铁的氧化物)为原料生产碱式氯化铝过程中遇到的情况:
(1)在反应器中加入16%的硫酸和16%的盐酸,在不断搅拌过程中再加入经过焙烧后的煤矸石粉,反应器上部有一条长管子作为反应时气体的排放管。加热至沸腾(102℃)并保持一段时间,期间不断用精密pH试纸在排气管口上方检查排出气体的pH,记录如下:
| 时间 | 起始 | 14min后 | 30min后 | 75min后 |
| pH | <2.0 | =2.5 | <3.5 | =3.5 |
试解释排气管中放出气体的pH变化的原因_____________________________________如果把排气管加长一倍,排气的pH_________(回答“增大”“减小”或“不变化”),解释原因____________________________
(2)上述反应结束后,冷却,过滤弃渣,然后再加热至100℃,并在不断搅拌的条件下,向溶液慢慢地添加Ca(OH)2至适量,生成大量沉淀。过滤上述溶液,弃渣,得到澄清的BAC稀溶液。将此稀溶液加热蒸发浓缩,又产生白色细晶状沉淀,经化验分析,知此沉淀不是BAC固体,也不是AlCl3晶体或Al(OH)3。问:这种物质是__________________,为什么此时会有沉淀析出_____________________________________
七、(本题包括2小题,共18分)
![]()
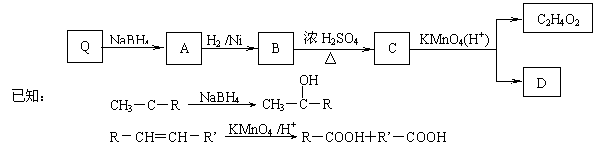 22.(8分)蜂皇酸是蜂王浆的主要活性成分之一,具有灭菌、防辐射、防脱发、抗癌等多种生理功能。蜂
22.(8分)蜂皇酸是蜂王浆的主要活性成分之一,具有灭菌、防辐射、防脱发、抗癌等多种生理功能。蜂
皇酸Q由C、H、O三种元素组成,且C、H、O三种元素的原子个数比为10∶16∶3,Q分子中没有支链。
1 mol Q需要1 mol NaOH 完全中和,1 mol Q可以和1 mol Br2 加成,其相对子质量不大于200。Q能发生
下列转化:
回答下列问题:
⑴ 写出Q的分子式___________。 ⑵ 上述转化过程中,发生氧化反应的官能团是____________。
⑶ 写出B → C的化学方程式_________________ 。
⑷ D有多种同分异构体,其中分子中只含一种官能团、烃基上一元取代物只有一种的同分异构体的结构简式是_________ 、 (要求写两种)。
![]() 23. (10分)生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),
23. (10分)生产工程塑料PBT(
)的重要原料G(1,4-丁二醇),
可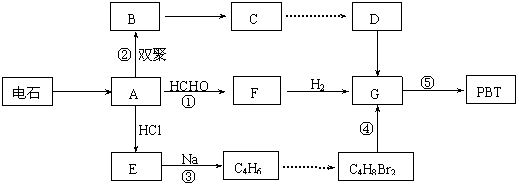 以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
请你结合下列所给有关信息,回答问题。
Ⅰ.CH2=CH-CH=CH2与Br2的CCl4溶液发生1∶1加成可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2二种产物。
![]()
![]() Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅲ.
![]() Ⅳ.
Ⅳ.
⑴写出E和F的结构简式: 、 。
⑵写出反应⑤的化学反应方程式: 。
⑶请你设计出由B→C…→D的反应流程图(有机物用结构简式表示,必须注明反应条件)。
![]() 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
![]() B C
…… G
B C
…… G
反应流程:
八、(本题包括2小题,共18分)
24.(8分)固体A是由C、H、O、K四种元素组成的复合物。实验测得1molA中含有1mol某二元酸、1mol该酸的酸式盐和2mol结晶水。取50.80g固体A配成1000mL溶液。取25mL上述溶液,可以恰好与0.5mol/L30.00mLNaOH溶液反应并生成正盐;另取25mL上述溶液,加入适量的稀硫酸,刚好使40.00mL0.1000mol/LKMnO4溶液褪色并生成CO2,将反应后的溶液稀释至90.00mL此时溶液中c(K+)为0.1000mol/L,且溶液中只含有K+、H+、Mn2+、SO42-及极少量的OH-。将生成的CO2全部收集并干燥后通过碱石灰,碱石灰增重0.8800g。
请回答下列问题:
(1)写出固体A的化学式 ;
(2)写出A与KMnO4溶液反应的化学方程式
。
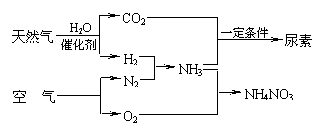 25.(10分)以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程
25.(10分)以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程
大体如下:
某工厂以标准状况下的含CH4 89.6%的天然气100 m3为原料经过上述过程,生产尿素和硝酸铵。
⑴ 合成氨生产过程中氨的产率为60%,假设其它各步反应均完全且不考虑副反应,求100 m3的天然气可生产尿素的质量。(注:产率为实际产量与理论产量之比)
⑵ 为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中 (不包含被硝酸吸收的氨气)氨气与空气的体积比。
⑶ 实际生产中,若氨的产率为60%,硝酸的产率为80%,求100 m3的天然气最多可生产硝酸铵的质量。