高三12月测化学试题
注意事项:1. 本试卷分选择题和非选择题二部分,共计150分, 考试时间为120分钟
2.选择题答题时,选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.
3.可能用的相对原子质量:H 1 C 12 O 16 Mg 24 K 39 Mn 55 Cl 35.5
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.化学与科技、社会、生产密切结合,下列做法合理合法的是
A.汽油中添加乙醇制备“乙醇汽油”,可有效减少有害气体的排放。
B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观。
C.化妆品中添加含铬物质制美白润肤“SK-Ⅲ”,可使女性青春永驻。
D.汽水中添加林丹、毒死蜱和七氯等杀虫剂制“可口可乐、百事可乐”,增强口感和余味。
2.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
A.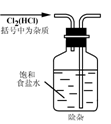 B.
B.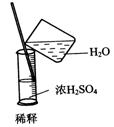
C.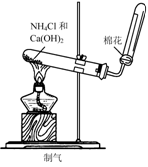 D.
D.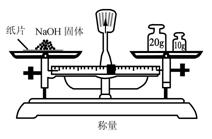
3.设NA表示阿伏加德罗常数,下列叙述中,正确的是 ( )
A.常温常压下,16gO2和O3的混合物中共含有NA个氧原子
B.假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78gNa2O2固体中所含阴、阳离子总数为4NA
D.在铜与硫的反应中,1mol铜原子参加反应失去的电子数为2NA
4.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
5.下列表述正确的是
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
③化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
④太阳能电池可采用硅材料制作,其应用有利于环保、节能
⑤游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
A.①②③ B.③④⑤ C.②④ D.③⑤
6.X、Y、Z均为短周期元素。已知X元素的原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应物质的是
A.①②④⑤ B.①②③④ C.②③④ D.②⑤⑥
7.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A.All4与ⅡA族元素性质相似性
B.A113与卤素性质类似
C.A113在气相中与HI反应的方程式可表示为:A113 + HI = HAl13I
D.A113超原子中A1原子间是通过离子键结合的
8.有M、N两溶液,各含有下列十四种离子中的七种离子:Al3+、Cl—、Na+、K+、NO3—、OH—、S2-、MnO4—、Fe3+、NH4+、H+、SO42—、CO32—、AlO2—。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是
A.MnO4—、SO42—、NO3— B. OH—、S2—、CO32—
C.Cl—、NO3—、SO42— D.AlO2—、MnO4—、SO42—
9.某化工厂的工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理,使之基本呈中性,处理方法如图所示:
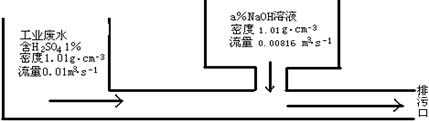
若处理后的废水pH=7,则所用NaOH溶液中溶质的质量分数为
A.0.5% B.1% C.2% D.4%
10.Co3+的八面体配合物(配位数为6)CoClm·nNH3,若1mol该配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是( )
A.m=1、n=5 B.m=3、n=4 C.m=5、n=1 D.m=4、n=5
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
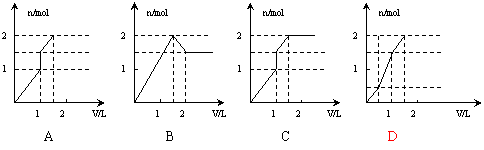 |
11.向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
12.对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.该反应的化学平衡常数表达式为:K = ![]()
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.45倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)mol
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
13.相互反应时,无论何种试剂过量离子方程式都正确的是
![]() A.盐酸与NaAlO2溶液:
A.盐酸与NaAlO2溶液:![]() +H++H2O
Al(OH)3↓
+H++H2O
Al(OH)3↓
![]() B.石灰水与磷酸二氢钠溶液:2H2PO
B.石灰水与磷酸二氢钠溶液:2H2PO![]() +3Ca2++4OH- Ca3(PO4)2↓+4H2O
+3Ca2++4OH- Ca3(PO4)2↓+4H2O
![]() C.明矾溶液与小苏打:Al3++3HCO
C.明矾溶液与小苏打:Al3++3HCO![]() Al(OH)3+3CO2↑
Al(OH)3+3CO2↑
![]() D.硫酸氢钠溶液和氢氧化钡:SO
D.硫酸氢钠溶液和氢氧化钡:SO![]() + 2H+ +Ba2+ + 2OH- BaSO4↓
+ 2H2O
+ 2H+ +Ba2+ + 2OH- BaSO4↓
+ 2H2O
14.下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对;Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对;Ⅱ错;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | I对;Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对;Ⅱ对;有 |
15.化合物A、B、C、D各由两种元素组成,甲、乙、丙是三种单质。这些常见的化合物与单质之间存在如下关系(已知化合物C是一种有机物),
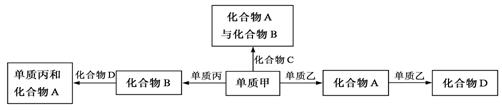
以下结论不正确的是
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体均是分子晶体
D.上图所示的五个转化关系中,均为放热反应
16.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
A.一氯代物的同分异构体只有三种
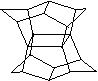 B.分子中含有二个亚甲基(—CH2—)
B.分子中含有二个亚甲基(—CH2—)
C.分子中含有4个五元碳环
D.分子式为C20H20
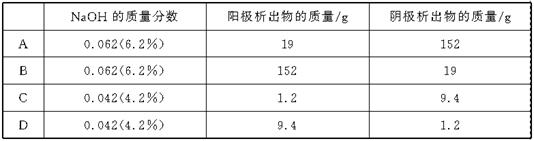
17.将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
![]()
![]() 18、甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数
18、甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ- Al2O3催化剂,合成反应为:CO+2H2
CH3OH,工艺中一些参数
![]() 如右图;
如右图;
目前正在开发的新法是:2CH4+ O2 2CH3OH 。
下列关于新法和旧法的说法正确的是
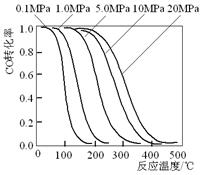 A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
A.旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应
B.旧法生产中,选择合适催化剂时,可推测高压法合成比低压法合成更有发展优势。
C.新法与旧法相比,原料丰富并可直接从天然气中获得
D.新法生产中,需控制V(CH4)/V(O2)=9∶1,目的是提高空气中氧气的转化率
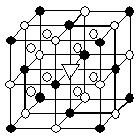 19. 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6
=3Na+ + AlF6—
19. 冰晶石(化学式为Na3AlF6)的结构单元如右图所示,已知冰晶石熔融时电离方程式为Na3AlF6
=3Na+ + AlF6—
●位于大立方体顶点和面心
○位于大立方体的12条棱的中点和8个小立方体的体心
那么大立方体的体心处▽所代表的微粒是
A.Na+ B.Al3+
C.F— D.AlF6—
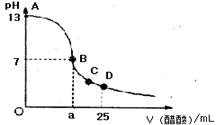 20.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
20.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有
c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
B.在B点,a>12.5,且有
c(Na+)==c(CH3COO—)=c(OH—)==c(H+)
C.在C点:c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
D.在D点:c(CH3COO—)十c(CH3COOH)==2c(Na+)
三、(本题包括2小题,共24分)