 高三‘二诊’理科综合能力测试(化学部分)
高三‘二诊’理科综合能力测试(化学部分)
可能用到的相对原子质量: H—1 C—12 O—16 S—32 Ba—137 Na—23 S -32
Cl -35.5 Fe -56 Cu -64
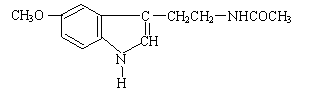 6、人体脑内有松果体腺,能分泌一种具有调节睡眠作用的物质,它的分泌量的大小随时间、光线、昼夜变化等条件的不同而变化,比如晚上分泌得多,白天分泌得少。这种物质叫松果体素,又叫褪黑素,也就是保健市场上出售的“脑白金”。脑白金的有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
6、人体脑内有松果体腺,能分泌一种具有调节睡眠作用的物质,它的分泌量的大小随时间、光线、昼夜变化等条件的不同而变化,比如晚上分泌得多,白天分泌得少。这种物质叫松果体素,又叫褪黑素,也就是保健市场上出售的“脑白金”。脑白金的有效成分的结构简式如图所示,下列对该化合物的叙述正确的是
A.它属于氨基酸
B.它属于高分子化合物
C.分子式为C13N2H14O2
D.在一定条件下可以发生加成反应和水解反应
7、下列叙述正确的是:
A. pH=3和pH=5的盐酸各10mL混合,所得溶液的pH=4
B. 将25 °C纯水加热至95°C时,而![]() 增大
增大
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D. 依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低
|
A.CH3CH2OH(气)B.NH3
C.CO和H2 D.H2
9、.短周期元素A、B、C,原子序数
依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C B.沸点:A的氢化物低于C的氢化物
C.B的硫酸盐溶液pH<7 D.5.6 g铁与足量的C化合,转移0.3 mol电子
10、合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
![]() N2(g)+3H2(g)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)
N2(g)+3H2(g)
2NH3(g) ;△H< 0 。 400℃、30MPa下n(NH3)和n(H2)
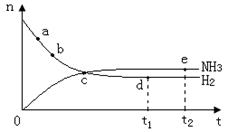 |
随时间变化的关系如右图,下列叙述错误的是( )
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,
n(H2)比右图中d点的值大
11、下列溶液中,能大量共存的离子组是
A.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42-
B.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
C. c(H+)=1×10-2mol·L-1的溶液:Na+、NH4+、CO32-、SO42-
D.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
![]() 12、可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
12、可逆反应A(g)+3B(g) 2C(g);△H<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2kJ,已知Q1=3Q2。下列叙述不正确的是( )
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动
![]() D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol—1
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+Q2
kJ·mol—1
13、下列叙述正确的是 ( )
A.同一主族的元素,原子半径越大,其单质的熔点越高;晶体熔化时,化学键不一定发生断裂
| |
C.将pH=2,体积相同的盐酸和醋酸溶液均稀释100倍后,分别加入足量的相同颗粒大小的锌,产生H2的起始速率相同,醋酸放出的氢气多
D. 位于短周期的X元素的阳离子与Y元素的阴离子具有相同的电子层结构,则两元素的最高化合价X<Y
第Ⅱ卷(非选择题)
26.(19分)I、(4分)在中学化学实验中学过的可用于分离或提纯的方法很多,如重结晶、过滤、盐析…,请将分离或提纯下列各混合物最适宜的方法的名称添入括号内
①除去生石灰中混有的石灰石 ( )
②除去碘中混有的碘化钠固体 ( )
③除去乙醇中溶解的少量食盐 ( )
④除去氢氧化铁胶体中混有的氯离子 ( )
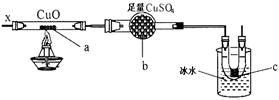
II、(15分)某校研究性学习小组设计了如图所示装置进行有关实验,实验时将分液漏斗中A逐滴加入烧瓶B中,(图中铁架台、铁夹已略去,要求填写的试剂的均填化学式)
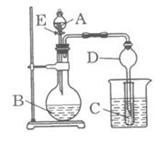 (1)若A为浓硫酸,B为第三周期金属元素的单质,
(1)若A为浓硫酸,B为第三周期金属元素的单质,
其在常温下难与水反应;C为品红溶液,实验
观察到C中溶液褪色,则B是 ,
简述判断B的理由 ,
若使C试管溶液恢复原来的颜色,可采取的操作
为 。
(2)若B为块状大理石,C为饱和Na2CO3溶液,实验中观察到小试管内溶液变浑浊,则C试管中发生反应的化学方程式为 。
(3)若B是生石灰,实验中观察到C溶液中先形成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭E,然后将C放入盛有沸水的烧杯中,静止片刻,观察到试管壁上出现光亮银镜。则A是 ,C是 与葡萄糖的混合液。该银镜反应的离子方程式为__ ,
仪器D在此实验中的作用是 。
(4)利用此套装置设计实验证明碳酸、醋酸、苯酚的酸性强弱,则A、B、C中放的试剂分别是 、 、 ,B、C的实验现象分别为B 、C 。若使现象明显,放入C中的溶液应是稀溶液还是浓溶液 。(填浓或稀)
27、(15分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的名称
A. C. E .
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为:
(3)已知DB2在一定条件下可转化为DB3,1mol DB2充分反应,放出98.3kJ的热量。该反应的热化学方程式是 ,工业上进行这一反应的设备是
,反应的适宜条件为 。
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,检验阳极产物的实验方法为
;电解一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。若改用铁棒做阳极材料,则阳极的电极反应式为 。
28、(17分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
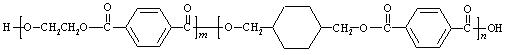
EG TPA CHDM TPA
已知:Ⅰ.![]()
![]()
![]()
![]()
Ⅱ.RCOOR1+R2OH→RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线
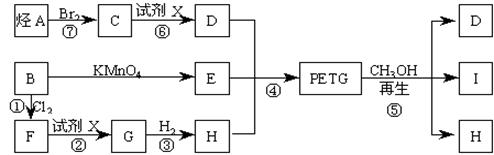
试回答下列问题:
(1)合成PETG的单体有_______种,反应②、⑥中加入的试剂X是_____________;
(2)⑤的反应类型是________________;
(3)写出结构简式:B______________________,I________________________;
(4)合成时应控制的单体的物质的量n(D):n(E):n(H)=__:_____:__(用m、n表示)。
(5)写出化学方程式:
反应③:____________________________________________________;
反应⑥:_____________________________________________________。
(6)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体共有______种.
29、(9分)(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”)。
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-) - c(M+) = _________ mol·L-1 c(H+) - c(MOH) = __________ mol·L-1
高三‘二诊’理科综合能力测试(化学部分)
4月4日练参考答案
6 D 7 B 8 A 9 C 10 C 11 D 12 D 13 B
26、(19分)I、(4分)①加热分解 ②升华 ③蒸馏 ④渗析(每空1分,共4分)
II、(15分)(1)B是Mg;理由是第三周期元素Na、Mg、Al中①在常温下难与水反应排除Na,②常温下与浓硫酸反应排除Al;加热试管C或放入沸水浴
(2)Na2CO3+CO2+H2O=2NaHCO3↓
(3)A是浓NH3·H2O,C是AgNO3,
CH20H(CHOH)4CHO+2[Ag(NH3)2]++20H→CH20H(CHOH)4C00-+N![]() +H20+2Ag+3NH3↑
+H20+2Ag+3NH3↑
D是作用是防止倒吸
(4)CH3COOH、NaHCO3、C6H5ONa;B中有气泡产生,C中溶液变混浊;浓。
27(15分)(1)氢、钠、氯; (2)H2O2+SO2=H2SO4;
![]() (3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
(3)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol;
接触室:400-500℃,催化剂;
(4)使湿润的淀粉碘化钾试纸变蓝:Cl2+2OH—=ClO—+Cl—+H2O;Fe-2e—=Fe2+
28.(17分)
(1)合成PETG的单体有___3______种(1分)(NaOH溶液 (2分)
(2)取代(或醇解)(2分)
(3)![]() (2分)
(2分) ![]() (2分)
(2分)
(4)m∶(m+n)∶n (2分)
(5)![]() +3H2
+3H2![]()
![]()
![]() (2分,未写反应条件不计分)
(2分,未写反应条件不计分)
CH2Br-CH2Br+2H2O![]()
![]() HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
HOCH2-CH 2OH+2HBr (2分,未写反应条件不计分)
(6)7种(2分)
29、(9分)(1)2(2分),Ba2++2OH—+2H++SO42— BaSO4+2H2O(2分)
(2) ① > ② 9.9×10-7 1.0×10-8(每空2分)