高三化学(临考)综合练习二
班级 姓名 号数
附:答题所需相对原子质量:Cu—64 C—12 H—1 O—16 K—39 Ca—40 Na—23
一、选择题(每小题6分,共48分。每小题只有一个正确答案)
1、下列古代发明或活动与化学关系不大的是
A.黑火药 B.钻木取火 C.炼丹术 D.造纸术
2、下列变化过程中,体系温度下降的是
A.硫酸溶于氢氧化钠溶液 B.铝热反应
C.液溴和苯在铁粉存在下制溴苯 D.硝酸铵溶于水
3、下列实验操作不会引起安全事故的是
A.排水法收集气体后,先熄灭酒精灯,再取出导气管
B.氢气还原氧化铜时,先加热再通入氢气
C.实验室制取氯气时,先加热二氧化锰,后滴入浓盐酸
D.混合浓硫酸和浓硝酸时,应将浓硫酸慢慢加入浓硝酸中并及时搅拌
4、在通常情况下,下列各组微粒能够大量共存的是
A.SO2、O2 B.NH3、HC1
C.A13+、HCO3-、C1-、Na+ D.Fe、Fe2+、Cu2+、Cu
5、为了进一步提高合成氨的生产效率,科研中最有开发价值的是
A.录求氮气新来源 B.研制低温下活性较大的催化剂
C.研制500℃左右活性较大的催化剂 D.研制耐高温、高压的新材料
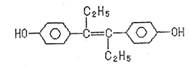
|
A.可以用有机溶剂萃取
B.1mol该有机物可以与5molBr2发生反应
C.可与NaOH和NaHCO3发生反应
D.该有机物分子中,可能有18个碳原子共平面
7、NA代表阿佛加德罗常数,下列说法正确的是
A.11.2L的臭氧所含原子数为1.5NA
B.286 g Na2CO3·10H2O晶体中所含CO32- 的数目小于NA
C.3.2g铜和足量的硫反应转移电子数为0.05NA
D.13 g 13C所含的质子数为13 NA
8、一定温度下,影响一定质量气体体积大小的决定因素是
A.气体的密度 B.气体分子体积的大小
C.气体分子间的平均距离 D.气体的相对分子质量
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、非选择题(60分)
9、(15分)二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解。以下是氯气与硫合成二氯化硫的实验装置。
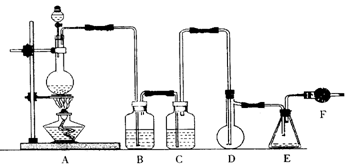
试回答下列问题
(1)装置A中发生反应的化学方程式为 。
(2)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是
。
(3)实验时,D装置需加热至50—59℃.最好采用 方式加热。如何防止E中液体挥发 。
(4)F装置中干燥管内所盛物质的作用是 。
(5)二氯化硫电子式为 。
10.(15分)现有A~F六种化合物,有关它们的信息如下。①、②中有一反应是与Br2的CCl4溶液的加成反应。1molF在碱性条件下水解生成1molG和1molH。G为油脂的水解产物。
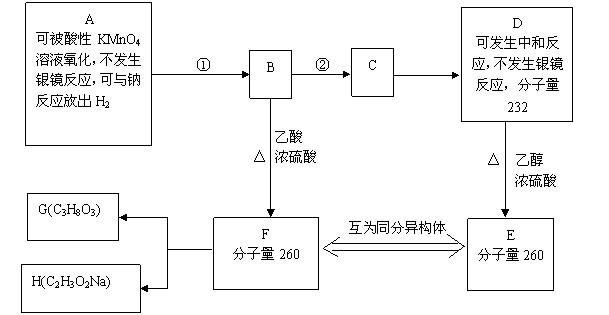 请回答下列问题
请回答下列问题
(1)与Br2的CCl4溶液发生加成反应的是 (填反应编号①或②)
(2)D中含有的官能团有
(3)A的结构简式为 ;E的结构简式为
(4)写出F在碱性条件下水解的化学方程式
_______________________________________________________________________________
11、(10分)有一种复盐X,其水溶液呈现浅绿色,在一定条件下,X可发生如下的转化关系,其中B、D、E、I为无色气体,M、K为常见的金属,H为红棕色的粉末,在溶液A中加入盐酸酸化,再加BaCl2溶液,生成白色沉淀。
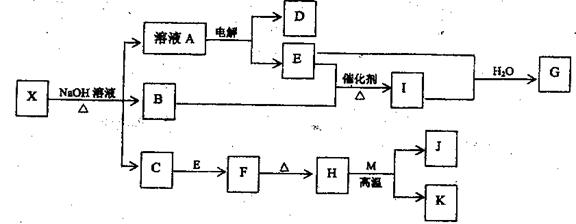
回答下列问题:
(1)B气体的检验方法是 。
(2)写出下列有关的化学方程式:
①电解溶液A:
②X与NaOH溶液共热
(3)写出K与过量G稀溶液反应的离子方程式:
12、(20分)
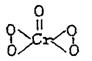
(Ⅰ)K2Cr2O7和H2O2在H2SO4溶液中混合时,可以看到下面两个现象:
①混合后5s—10s内,溶液由橙色变暗蓝色;
②在80s —160s内由暗蓝色变为绿色,与此同时,放出气泡。
与之相对应的两个方程式为:
A:Cr2O72‑+H2O2→CrO5+H2O
|
CrO5的结构式为:
(1)指出A、B是否属于氧化原还反应。
(2)配平A、B反应组成的总反应方程式,并标出反应的电子转移方向和数目。
(3)若反应中生成O2 11.2L(标准状况),H2O2 (填:得到或失去)电子的数目为 个。
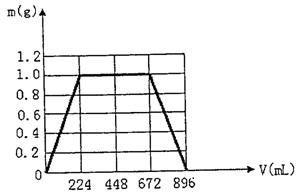
(Ⅱ)将KOH和Ca(OH)2混合物1.86 g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)
(1)生成沉淀的质量刚好最大时,反应的方程式为:
。
(2)原混合物中Ca(OH)2的质量为 g。
(3)沉淀恰好溶解时,消耗CO2的体积为 mL
|
高三化学(临考)综合练习二(参考答案)
1、B 2、D 3、D 4、A 5、B 6、C 7、C 8、A
|
(1)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O (2分) (2)增大反应接触面 (3分)
(3)水浴;(2分) 将锥形瓶放人冰水中冷却(2分)
(4)防止空气中水蒸气进入E中并吸收残留的氯气。(3分)
(5) ![]() (3分)
(3分)
10.(15分) (1)①;(3分) (2)羧基、溴原子;(3分,写结构简式也给分)
(3)A:CH2=CHCH2OH;(3分) E:CH2BrCHBrCOOCH2CH3;(3分)
(4)CH3COOCH2CHBrCH2Br+3NaOH →CH3COONa+CH2OHCHOHCH2OH+2NaBr(3分)
11、(15分)(1)将润湿的红色石蕊试纸放在试管口,试纸变蓝(2分)
|
②(NH4)2Fe(SO4)2+4NaOH==2NH3↑+Fe(OH)2+2Na2SO4 +2H2O(3分)
(3)Fe+4H++NO3- === Fe3++NO↑+2H2O(3分)
12、(20分)
(Ⅰ)(8分)
(1)A否,B是(2分)
6e
(2)Cr2O72-+3H2O2+8H+→2Cr3++3O2↑+7H2O
(配平2分,转移电子数2分)
(3)失去(1分),NA(1分)
(Ⅱ)(12分)
(1)CO2+Ca(OH)2=CaCO3↓+H2O(2分)
(2)0.74g(3分)
(3)896mL(3分)
(4)(4分)
|