化学高考模似卷
江苏省苏州中学:张惠飞(原启东中学奥化教练)
本试卷分第I卷(选择题)第II卷(非选择题)两部分。共150分,考试用时120分钟
第I卷(选择题 共72分)
可能用到的原子量:H—1 C—12 N—14 O—16 Na—23 Cl—35.5
S—32 Fe—56 Cu—64 I—127 P—31
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1. 1999年度诺贝尔化学奖获得者艾哈万德·泽维尔(AbmedH·Zewail),开创了“飞秒
(10-15S)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是…………………………………………………………( )
A.化学变化中反应物分子的分解 B.反应中原子的运动
C.化学变化中生成物分子的形成 D.原子核的内部结构
2.如限定使用以下的物质:盐:钾盐 钠盐 铵盐 钡盐,酸:盐酸 硝酸 醋酸
稀硫酸。那么符合:2H++SO32-=SO2↑+H2O这个离子方程式的化学反应式共有…( )
A.9个 B.12个 C.15个 D.6个
3.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是…………………………………( )
A.化学不再是纯实验科学 B.化学不再需要实验
C.化学不做实验,就什么都不知道 D.未来化学的方向还是经验化
4.由IIIA族元素A和VI族元素B组成的阴离子结构如下图,所带电荷数x y z依次为
……………………………………………………………………………………………( )
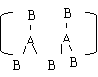 |
|  |  | |||||
B
A.2.3.4 B.2.3.2 C.5.6.4 D.4.3.2
5.为除去SO2中混有的少量SO3,并使所得物质的平均相对分子质量尽可能地增大,应选用的物质是……………………………………………………………………………( )
A.亚硫酸钠溶液 B.饱和亚硫酸氢钠溶液
C.碱石灰 D.浓硫酸
6.用NA表示阿伏加德罗常数,下列说法正确的是………………………………( )
A.78gNa2O2与足量水反应中电子转移了0.2NA
B.1mol甲基中含有7NA个电子
C.62g白磷中含P—P键为3NA
D.1mol氖气含有的原子数为2NA
7.有一关于实验操作的谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安。”这一实验操作是指……………………………………………………( )
A.将金属钠保存在水中 B.将盛有一粒白磷的一烧杯水加热至60℃
C.用压强计测某一深度处的水压 D.稀释浓硫酸
8.近年来科学家发现有100个碳原子构成一个具有完美对称性的C100原子团,其中每个碳原子仍可形成4个化学键。最内层是由20个碳原子构成的正十二面体(即每个碳与其它三个碳相连)。外层的60个碳原子形成12个分立的正五边形(即每个碳原子与其它2个碳相连)。处于中间层次的碳原子连接内外层碳原子。当它与氢或氟形成分子时,其分子式为
………………………………………………………………………………………………( )
A.C100H20和C100F20 B.C100H60和C100F60
C.C100H12和C100F12 D.C100H40和C100F40
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选择符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.两种有机物以一定比例混合,一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中可能符合此条件的是……( )
A.CH4 C2H4 B.CH3OH CH3COOH C.C2H6 HCHO D.HCOOH,CH3COOCH3
10.常温下,分别将4块形状相同,质量均为7g的铁片同时投入下列四种溶液中,产生H2速率最快的是………………………………………………………………………… ( )
A.150ml , 2mol/l HCl B.500ml , 2mol/l H2SO4
C.50ml ,3mol/l HCl D.50ml , 18.4mol /L H2SO4
11.金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右图所示。
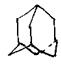 金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是………………………………………………………………( )
金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是………………………………………………………………( )
A.4种 B.6种 C.8种 D.10种
12.用已知浓度的NaOH溶液测定某强酸的浓度,表中的正确选项是…………( )
| 锥形瓶中溶液 | 滴点管中溶液 | 选用指示剂 | 选用滴点管 | |
| A | 碱 | 酸 | 石蕊 | 碱式 |
| B | 酸 | 碱 | 酚酞 | 酸式 |
| C | 碱 | 酸 | 甲基橙 | 酸式 |
| D | 酸 | 碱 | 酚酞 | 碱式 |
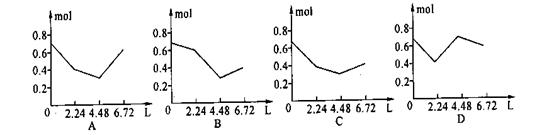 13.往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解和离子的水解都忽略不计)………………………………(
)
13.往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解和离子的水解都忽略不计)………………………………(
)
14.在100mL物质的量浓度相同的HBr和H2SO3的溶液里通入0.01mol Cl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于………………………………………( )
A.0.0075mol·L-1 B.0.008mol·L-1 C.0.075mol·L-1 D.0.08mol·L-1
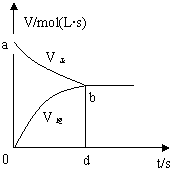 15.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应
15.在容积固定的2L密闭容器中,充入X、Y各2mol,发生可逆反应
![]() X(g)+2Y(g) 2Z(g),并达到平衡,以Y的浓度改变表示的反应速率
X(g)+2Y(g) 2Z(g),并达到平衡,以Y的浓度改变表示的反应速率
v正、v逆与时间t的关系如图。则Y的平衡浓度表达式正确的是(式中
S指对应区域的面积)…………( )
A.2-S aob B.1-Saob
C.2-Sabdo D.1-Sbod
16.室温下,将33.6克铁粉加到硝酸溶液中,两者全部参加反应,同时收集到11.2升一种气体(标准状况)下列说法正确的是……………………………………………………( )
A.原溶液是浓硝酸,含HNO3的量为3.6摩
B.原溶液必是稀硝酸,含HNO3的量为2.4摩
C.原溶液必是稀硝酸,含HNO3的量为1.6摩~2.4摩
D.原溶液必是稀硝酸,含HNO3的量为2.0摩
17.有机物A和B只有C、H、O、中2种或3种元素组成,等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为……………………………………………………………………………………( )
A.8n B.14n C.18n D.44n
18.有机物CH2=CHCH2CHCOOH在不同条件下至少可能发生7种不同类型的有机反应:
![]()
①加成、②取代、③消去、④氧化、⑤酯化、⑥加聚、⑦缩聚,其中由于分子结构中含-OH,可能发生的反应有…………………………………………………………………( )
A.①④⑥⑦ B.③④⑤ C.②③④⑤⑦ D.②③④⑤
第II卷(非选择题共78分)
 三、填空题
三、填空题
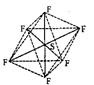
19.(4分)SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为________________________种(10种)
20.(12分)过碳酸钠Na2CO4和HCl反应的化学方程式为:
2Na2CO4+4HCL=4NaCl+2CO2↑+O2↑+2H2O
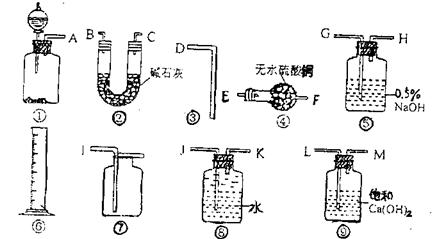 商品过碳酸钠中往往含有少量的Na2CO3,为了测定其纯度,现称取0.9克样品进行实验。供实验选用的仪器,试剂如下图:
商品过碳酸钠中往往含有少量的Na2CO3,为了测定其纯度,现称取0.9克样品进行实验。供实验选用的仪器,试剂如下图:
(1):为了使实验尽可能简单,应选用的装置是__________________。(填编号)
(2):所选用的装置的连接顺序是___________________________。(填字母)
(3):如实验有三种规格的量筒,体积分别为50ml、100ml、500ml。本实验选用的量筒规格应该是______________________________。
(4)假设实验时的温度为0℃,压强为1.01×105pa实验结束时,量筒中水的体积为Vml,写出表示样品纯度的计算式__________________________-。
21.(8分)(1)某饱和一元醇既不能发生消去反应,又不能发生催化氧化反应则该饱和一元醇中至少有_______________个碳原子(不考虑碳原子与碳原子之间断裂)
(2)若某饱和一元醇分子中有15个碳原子,且既不能发生消去反应,又不能发生催化氧化反应,则该酸可能有的同分异构体有____________种。
22.(16)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
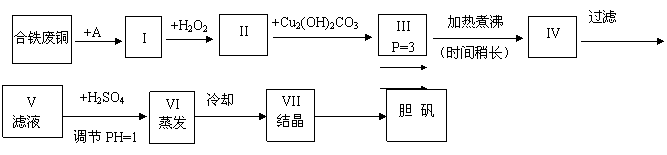
PH值控制可参考下列数据
| 物 质 | 开始测定时的PH值 | 光全测定时的PH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1) A物质可选用___________填字母。
(a)稀H2SO4 (b) 浓H2SO4 (c)浓FeCl3浓液d,浓HNO3
(2) I中加H2O2的目的___________________.
(3) II中加Cu2(OH)2CO3的目的是____________________________其优点是____________.
(4) III加热煮沸时发生的化学反应的离子方程式为__________________.
(5) V中加H2SO4调节PH=1是为了________________________________。
(6) 某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________________________________。若你是该工程师,将对所加的A物质作何改进?请提出建议_____________________________________.
23.(18分)A是一种可溶于水的有机。.从A出发,可发生图示的一系列反应而生成各种不同的有机化合物B、C、D、E、F、H。
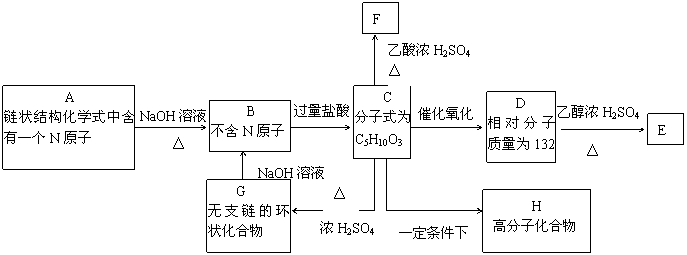
试写出:
(1)化合物的结构简式:A____________ D___________ E___________。
(2)化学方程式
C→F__________________________________________。
C→H__________________________________________。
G→B___________________________________________。
24.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1) 写出元素符号:A_____________,C______________.
(2) 写出两种均含有A、B、C、D四种元素的化合物相互作用逸出气体的化学方程式:___________________________________。
(3) 用A元素的单质和B元素的单质可以制成电池,电池中装有浓KOH溶液,用多孔的金属惰性电极浸入KOH溶液中,两极均有特制的气体透过性隔膜,在一极通入A的单质,另一极通入B的单质,则通入B单质的一极的电极反应方程式是__________。
四、计算题
25.(4分)用石墨作电极电解100mlH2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为多少?
26.(8分)著名的“候氏制碱法”第一步反应是向饱和氨化食盐水中通入二氧化碳,该反应可表示为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3+NH4Cl。有关物质的溶解度数据如下:(g/100gH2O)
| NaCl | NaHCO3 | NH4Cl | |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
现在45℃时,向434g饱和食盐水中通入适量氨气,再向其中通入二氧化碳后,按上述反应进行完全。试计算并回答下列问题:(计算时假设:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计。)
(1) 反应完全后,45℃时析出晶体的化学式是_____________,并计算析出晶体的质量为__________________。
(2) 过滤除去晶体后再降温至10℃,此时析出的晶体是(填化学式)____________,计算所析出晶体的质量。
【参考答案】
一、选择题
1.D 2.C 3.A 4.D 5.D 6.C 7.D 8.B
二、选择题
9.BD 10.B 11.C 12.CD 13.A 14.D 15.B 16.D 17.B 18.C
三、填空题
19. 10种
20.(1)①②⑧③⑥ (2)ABCKJD或ACBKJD
(3)100ml
(4)![]()
21.(1) 13 4
22.(1)b
(2)氧化溶液中可能残留的Fe2+
(3)调节溶液的PH值,以除去Fe3+不引入新的杂质离子
|
![]()
![]() (4)Fe3++3H2O Fe(OH)3↓+3H+
(4)Fe3++3H2O Fe(OH)3↓+3H+
(5)防止Cu2+ 水解
(6)会产生SO2污染空气。先将废铜在O2中灼烧,然后再加稀H2SO4或在O2存在条件下将废铜与稀H2SO4在加热情况下反应
![]() 23.(1)A CH2—CH2—CH2—CH2—COONH4
23.(1)A CH2—CH2—CH2—CH2—COONH4
![]() CH2—COOH
CH2—COOH
D CH2
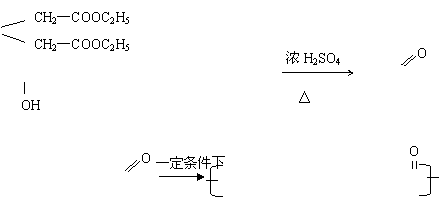
E CH2
(2)C→F: CH2—CH2—CH2—CH2—COOH+CH3OOH CH3—C—O—
CH2CH2CH2CH2-COOH+H2O
 C→H: nHOCHCHCHCH-C—OH O CH2CH2-CH2-CH2-CH2-C n+H2O
C→H: nHOCHCHCHCH-C—OH O CH2CH2-CH2-CH2-CH2-C n+H2O
|
+ NaOH CH2-CH2-CH2-CH2-C-ONa
24:(1)H Na
(2)NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
(3)O2+2H2O+4e===4OH
四、计算题
25.1mol/L
26. (1) NaHCO3 129g (2) 30.7
备用题
一、选择题
1.把Ba(OH)2溶液逐渐滴入到含amolKAL(SO4)2的明矾溶液中,生成沉淀的物质的量与所加入的Ba(OH)2的物质的量对应关系正确的是 ( )
A.3a,4a B.3a,2a C.2.5a, 1.5a D.2a,2a
2.判断下列分子式不可能的是 ( )
A.C8H13O2Br B.C3H7NO3 C.C4H8NO D.C5H7SH
二、填空题
3.已加:(1)乙醛甲基上的氢原子是a氢原子,活性较大,可以与甲醛中的醛基发生加成反应,如:
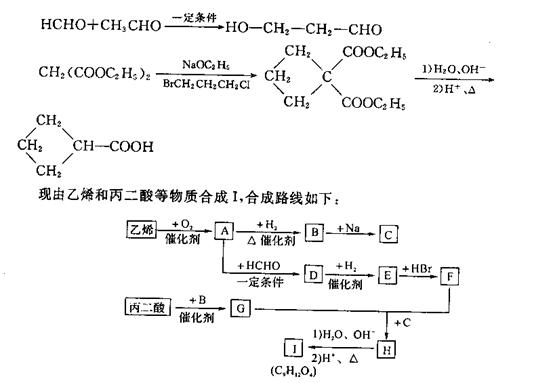
请回答下列问题:
(1)写出下列物质的结构简式:E___________、H__________、I______________;
(2)写出A→D的化学方程式:(有机物写结构简式):
_________________________________________________________________________。
4. 图中每一个方框内的字母代表一种物质,常温常压下,A、B、C和D均为单质,且B为金属,其它三种为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,有关反应的化学计量关系为:
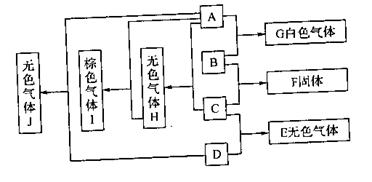
(1)A与B按物质的量之
比n(A ):n(B)=1:2完全反应生成G
(2)B与C按物质的量之比n(B):n(C)=3:1完全反应生成F
(3)C与D按物质的量之比n(C):n(D)=1:3完全反应生成E
请填空;
(1)物质B是_______________,物质C是___________________。
(2)B与C反应生成F的化学方程式为:______________________。
(3)A与H反应生成I的化学方程式为:_____________________。
三、计算题
5.已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:
(1)当Cl2与NO2混合气体的不同比例混合时,测得其平均式量(相对分子质量)分别为51用61。分别求出Cl2在上述混合气体中的体积分数。
(2)取上述不同比例的混合气体各5L,在一定条件下充分反应后气体体积均为4L,由此写出Cl2与NO2反应的化学反应方程式。
(3)设Cl2的体积分数为x(0<x<1)时,试讨论当x的取值不同时(Cl2与NO2总体积为5L)反应后总体积V随x变化的函数关系,将结果填入下表:
| X值 | V(反应后混合气体体积) |
备用题参考答案
1.CD 2.C
3.
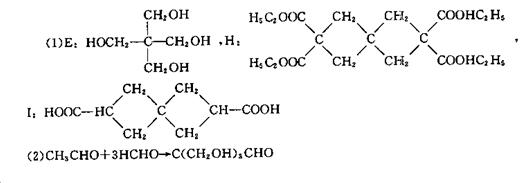
4.(1)Mg(镁) N2(氮气)
(2)3Mg+N2 Mg3N2
![]() (3)2NO+O2 2NO2
(3)2NO+O2 2NO2
5.(1)当![]()
![]() =51时,Cl2占
=51时,Cl2占![]()
![]() =61时
Cl2占
=61时
Cl2占![]()
(2)Cl2+2MO2=2NO2Cl
(3)0<x≤![]() V=5-5x
V=5-5x ![]() <x<1 V=
<x<1 V=![]()