高三化学第二次模拟考试卷
总分100分
第І卷 (选择题,共60分)
一、选择题(每小题只有一个选项符合题意,请将选择的选项填在选择题答题表中,每小题3分,共20题,共60分)
1、2006年9月21日,美国亚特兰蒂斯号航天飞机在爱德华空军基地安全着落,航天飞机表层的防热瓦曾成为航天飞机能否安全着落的制约因素。防热瓦是以石墨材料为主要成分的非常疏松的泡沫陶瓷。下列有关说法合理的是
A、石墨成为该泡沫陶瓷主要成分的主要原因是石墨是原子晶体
B、石墨成为该泡沫陶瓷主要成分的主要原因是石墨熔点很高
C、石墨中碳碳键之间的夹角为109°28'
D、C60也可代替石墨用作航天飞机表层的防热瓦材料
2、下列有关说法不符合事实的是
A、同温同压下,气体的体积取决于气体的物质的量的多少
B、元素的相对原子质量取决于该元素各核素的相对原子质量和在自然界中的原子百分比
C、氯化钠投入到酒精中将形成胶体
D、氧化剂的氧化性强弱取决于该氧化剂中某元素化合价的高低
3、关于某溶液所含离子检验的方法和结论正确的是
A、加入过量NaOH溶液,有白色沉淀生成,则原溶液一定有Mg2+
B、加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有Cl-
C、加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有
CO32-或SO32-
D、加入NaOH并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液是铵盐溶液
4、据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P== 3P2O5 + 5KCl ,则下列有关叙述错误的是
A、上述反应中氧化剂和还原剂的物质的量之比为5:6
B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C、上述反应中消耗3molP时,转移电子的物质的量为15mol
D、因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
5、碘化砹(AtI)可发生下列反应,①2AtI+2Mg==MgI2+MgAt2
②AtI+2NH3(l)==NH4I+ AtNH2。对上述两个反应的有关说法正确的是
A、反应①MgAt2既是氧化产物,又是还原产物
B、这两个反应都是氧化还原反应
C、反应②中AtI既是氧化剂,又是还原剂
D、MgAt2的还原性弱于MgI2的还原性
6、科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现A1的超原子结构A113和A114,并在质谱仪检测到稳定的Al13I-等。A113、A114的性质很象现行周期表中的某主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A、All4与ⅡA族元素性质相似
B、A113与卤素性质类似
C、A113在气态中与HI反应的方程式可表示为:A113+HI=HAl13I
D、A113超原子中A1原子间是通过离子键结合的
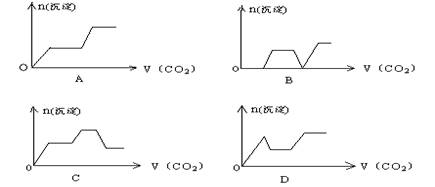
7、将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为:
8、某无色溶液中,由水电离出的c(H+)=1×10![]() mo1·L
mo1·L![]() ,则该溶液中,一定能大量共存的离子组是
,则该溶液中,一定能大量共存的离子组是
A.K+、Na+、MnO![]() 、SO
、SO![]() B.K+、Cl
B.K+、Cl![]() 、Ba2+、HCO
、Ba2+、HCO![]()
C.K+、Na+、Cl![]() 、Br
、Br![]() D.Na+、CO32一、A1O
D.Na+、CO32一、A1O![]() 、C1
、C1![]()
9、在等物质的量浓度的NaR、NaR′溶液中,分别通入适量的CO2发生如下反应:NaR+CO2+H2O=HR+NaHCO3 2NaR′+CO2+H2O=2HR′+Na2CO3 现有等物质的量浓度的NaR、NaR′、Na2CO3、NaHCO3四种溶液,其碱性强弱顺序为
A.NaR>NaR′>Na2CO3>NaHCO3
B.NaR′>Na2CO3>NaR>NaHCO3
C.Na2CO3>NaHCO3>NaR′>NaR
D.NaR′>NaR>Na2CO3>NaHCO3
10、下列变化中,属于物理变化的是
A.熔融态的KCl导电
B.在Fe(OH)3胶体中加入MgSO4溶液析出红褐色沉淀
C.用加热方法分离沙子和NH4Cl晶体
D.蓝色CuSO4晶体,受热变为白色CuSO4粉末
11、下列指定微粒个数比为2∶1的是
A.Be2+离子中的质子和电子
B.![]() 原子中的中子和质子
原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
12、下列离子方程式正确的是
A、等物质的量硫酸氢钠溶液跟氢氧化钡溶液混合:
H+ +SO42- +Ba2+ + OH- === BaSO4 ↓ + H2O
B、 将标准状况下112mL氯气通入10mL浓度为1mol/L的溴化亚铁溶液中:
2Fe2+ + 4Br- +3Cl2 === 2Fe2+ + 6Cl- +2Br2
C、 用NaOH吸收少量H2S:
OH- + H2S === HS- + H2O
D、向碳酸氢镁溶液中加入过量的澄清石灰水:
Mg2+ + 2HCO3- +Ca2+ +2OH- === MgCO3 ↓ +CaCO3 ↓ +2H2O
13、下列反应中,属于非氧化还原反应的是
A.3CuS + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 3S↓+ 4H2O
B.Br2 + 2KOH = KBr + KBrO + H2O
C.3H2O2 + 2KCrO2 + 2KOH = 2K2CrO4 + 4H2O
D.3CCl4 + K2Cr2O7 = 2CrO2Cl2 + 3COCl2 + 2KCl
14、已知酸性条件下有反应:2Cu+ == Cu2+ + Cu 。氢气还原氧化铜试验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜试验的红色固体产物作了如下实验,实验操作和实验现象列表如下:
| 加入试剂 | 稀硫酸 | 浓硫酸并加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体 蓝色溶液 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物:
 A.是Cu
B.是Cu2O
A.是Cu
B.是Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
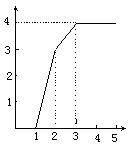
15、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
![]() A.1∶1∶1 B.1∶3∶1
A.1∶1∶1 B.1∶3∶1
C.3∶3∶8 D.1∶1∶4
16、在反应 aBrF3 + bH2O == cHBrO3 + dHBr + eHF + fO2 (a、b、c、d、e、f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C. 0.3mol D.0.4mol
17、以NA表示阿佛加德罗常数,下列说法中正确的是
A 53g碳酸钠中含NA个CO32-
B 0.1molOH-含NA个电子
C 1.8g重水(D2O)中含NA个中子
D 标准状况下11.2L臭氧中含NA个氧原子
18、已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2CH3COONH4== (CH3COO)2 Pb +(NH4)2SO4。当在(CH3COO)2 Pb(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成,表示这个反应的有关离子方程式是( )
A.(CH3COO)2 Pb +H2S==PbS↓+2 CH3COOH
B.Pb2++H2S==PbS↓+2H+
C.Pb2++2CH3COO—+H2S== PbS ↓+2 CH3COOH
D.Pb2++2 CH3COO— + 2H+ + S2—== PbS↓+2 CH3COOH
19、已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 KJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) == H2(g)+1/2 O2(g); △H1=+242 kJ·mol-1
B. 2 H2(g)+ O2(g)===2 H2O(l); △H2=- 484 kJ·mol-1
C. H2(g)+1/2 O2(g)====H2O(g) ; △H1=+242 kJ·mol-1
D. 2 H2(g)+ O2(g)===2 H2O(g); △H2=+484 kJ·mol-1
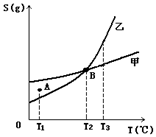 20、甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
20、甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
A、A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B、B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物
质的量浓度相等
C、将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的
乙比析出的甲多
D、若乙中含有少量的甲,可用重结晶的方法提纯乙
第І卷 (非选择题,共40分
二、填空与简答
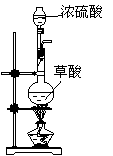
21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此设计如下实验方案:
| 序号 | A | B | C | D | E |
| 仪器及药品 |
|
|
|
|
|
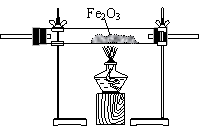
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:H2C2O4![]() CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作第一步应是 ;最后一步应是
熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用
是 。
第二步 :将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
22(10分)、工业上用饱和食盐水作原料,用电解方法制取烧碱。
(1)写出电极反应和总化学方程式:阳极______________________,阴极_________________________;总反应________________________。
(2)NaOH在_________极附近生成;
(3)电极材料为石墨和铁网,阳极必须用_________,原因是
___________________________________________;
(4)电解过程中可能发生的副反应有两个,它们是:
______________________________________,
(5)若将电解槽内的隔膜去掉,同时升高电解液的温度,此时电解产物间发生反应:NaOH+Cl2→NaClO3+NaC1+H2O(未配平),假设反应进行完全,则在该条件下最后得到的两种产物的物质的量之比是______________
(6)若在NaClO3溶液中加入固体KCl,则可得到重要工业产品KClO3晶体,其原因是_______________________________________________。
23(10分)、如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去) 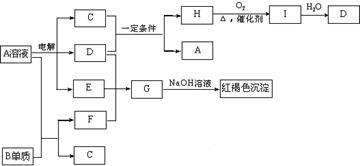 请回答下列问题:
请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
(1)V= L(用含x的代数式表示)。
(2)当x= 时,V的值最水,其值为 L。
(3)当V=2.016L时,第一次加热所得固体的质量为 g。
参考答案
1B 2D 3C 4D 5A 6D 7C 8C 9B 10B 11A 12A 13D 14D 15D 16A 17B 18、A 19A 20D
21、(1)A→E→C→D→B(2)连接好并检查气密性,A
(3)处理未反应完的CO和新生成的CO2 除CO2 (4)搅拌,过滤
(5)在HCl气体中加热浓缩,冷却结晶。
22、
(1)2Cl--2e==Cl2
2H+2e==H2 2NaCI+2H2O ![]() 2NaOH+H2+O2
2NaOH+H2+O2
(2)阴
(3)石墨;因为阳极发生氧化反应故必须用惰性电极
(4)2NaOH+Cl2===NaCl+NaClO+H2O O2+H2O===HCl+NaClO
(5)n(NaClO3):n(H2)==1:3
(6)KClO3溶解度比NaClO3小
23、(1)2CuSO4+2H2O
![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
(2)Cu+2H2SO4
![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)Fe2(SO4)3
(4)石墨(其他合理答案也可)
Fe-2e-==Fe2+
24、(1)(0.1-0.04x)22.4 (2)1 1.344 (3)6.16