高三化学第二次月考
可能用到的原子量:
Na—23, N—14, H—1, Cu—64, O—16, C—12,
第Ⅰ卷 选择题(共64分)
一. 单项选择,每题4分,共32分。
1、用氯气漂白过的石蜡(一种从石油分馏得到的固体),燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生了
A、物理溶解 B、加成反应 C、消去反应 D、取代反应
2、不能用水浴加热的实验是
A、苯的硝化反应 B、银镜反应 C、乙酸乙酯的水解 D、由乙醇制乙烯
3.下列物质属于分子晶体的化合物是
A、石英 B、硫磺 C、食盐 D、干冰
4.2001年9月1日将执行国家食品卫生标准规定,酱油中3一氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。相对分子质量为94 . 5的氯丙醇(不含主![]() 结构)共有
结构)共有
A、2种 B、3种 C、4种 D、5种
5、下列有关气体体积的叙述中,正确的是
A、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
C、不同的气体,若体积不同,则它们所含的分子数也不同;
D、气体摩尔体积是指1摩尔任何气体所占的体积约为22 . 4L
6、起固氮作用的化学反应是
A、N2和H2在一定条件下反应生成NH3; B、NO与O2反应生成NO2;
C、NH3经催化氧化生成NO; D、由NH3制碳酸氢铵和硫酸铵。
7、用石灰水保存鲜蛋是一种化学保鲜法。其原理是①石灰水是电解质溶液,能使蛋白质凝聚;②石灰水能渗入蛋内中和酸性物质;③石灰水能与鲜蛋呼出的CO2反应生成碳酸钙薄膜,起保护作用;④石灰水具有较强的碱性,杀菌能力强
A、①② B、③④ C、①③ D、②④
8.六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。下式中能表示六氯苯的是
 |
A、 B、 C、 D、 二、选择题(每小题4分,8小题共32分,每小题有一个或两个正确选项。)
![]() 9、在固定体积的密闭容器中,一定温度下,加入2molBr2和1molH2发生反应:H2(g)
+ Br2(g)
2HBr 达到平衡时,HBr的质量为W;要相同条件下,按下列情况充入物质,
9、在固定体积的密闭容器中,一定温度下,加入2molBr2和1molH2发生反应:H2(g)
+ Br2(g)
2HBr 达到平衡时,HBr的质量为W;要相同条件下,按下列情况充入物质,
达到平衡时,HBr的质量仍为W的是
A、2molHBr B、3molHBr C、4molBr2 + 2molH2 D、1molBr2 + 2molHBr+1molNe
10、重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定:
pD = - lg[D+],以下关于pD的叙述中,正确的是
A、中性溶液中pD=7.0
B、含0.01mol的NaOD的D2O溶液1L,其中pD=12
C、溶解0.01molDCl的D2O的溶液1L,其pD=2
D、100mL0.25mol/L DCl重水溶液中,加入50ml0.2mol/LNaOD的重水溶液后pD变为1.0
11、用N0代表阿佛加德罗常数,下列说法正确的是
A、360gC60晶体中的分子数为N0
B、标况下,11.2LSO3所含的分子数目为0.5 N0
C、用浓盐酸还原氯酸钾制取Cl2,生成0.5molCl2时,电子转移数目为N0
D、0.1molCH5+ 所含的电子数目为N0。
12.混合下列各组物质使之充分反应,加热蒸干产物并灼烧至质量不变,最终残留固体为纯净物的是
A、向CuSO4溶液中加入适量铁粉;
B、等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C、等物质的量的NaHCO3与Na2O2固体;
D、在NaBr溶液中充入过量氯气;
13、有关药品的保存和使用不正确的是
A、溴水盛于带磨砂玻璃塞的细口瓶中;
B、硫酸铜粉末、氯化钙等药品应贮存于干燥器中
C、白磷浸入水中密封保存;
D、用碳酸钠滴定未知浓度的盐酸,碳酸钠盛于酸式滴定管中。
14、将铁屑溶于滴有KSCN溶液的过量盐酸后,再加入下列物质,溶液呈红色的是
A、硫酸 B、硝酸锌 C、氯化铜 D、氯水
15、下列说法中,正确的是
A、室温下,HClO分子不可能存在于pH>7的溶液中;
B、在[OH-]=[H+]的溶液中,AlO2- 不可能大量存在;
C、在NaAlO2溶液中,HCO3- 不可能大量存在;
D、在水溶液中石炭酸比碳酸容易电离。
16.将40mL 1.5mol/L的CuSO4溶液与30ml 3mol/L的NaOH溶液混合,生成浅蓝色的沉淀,假如溶液中[Cu2+]或[OH—]都已变得很小,可忽略,则生成沉淀的组成可表示为
(A) Cu(OH)2 (B)CuSO4•Cu(OH)2
(C)CuSO4•2Cu(OH)2 (D)CuSO4•3Cu(OH)2
第Ⅱ卷 非选择题(共86分)
17.(6分)下列有关实验的叙述,正确的是(填序号)(少一个扣一分,多一个倒扣一分,扣完为止) 。
(A)配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
(B)用渗析法分离淀粉中混有的NaCl杂质
(C)无法用分液漏斗将甘油和水的混合液体分离
(D)用酸式滴定管量取20.00mL高锰酸钾溶液
(E)为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
(F)用浓氨水洗涤做过银镜反应的试管
(G)配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
(H) 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(J)在氢氧化铁胶体中加少量硫酸会产生沉淀
(K)用结晶法可以除去硝酸钾中混有的少量氯化钠
18.(12分)在实验室中拟用氧化铜、稀硫酸、和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案。
甲:(1)CuO溶于适量稀硫酸中;
(2)在(1)的溶液中加入适量锌,反应一段时间后,过滤、烘干,即得纯净的铜。
乙:(1)锌与稀硫酸反应得氢气;
(2)利用中学化学中教材H2和CuO的反应装置,将氢气通入氧化铜中并加热,充分反应一段时间后即得纯净的铜。问:
①若要制得相同质量的纯铜,甲乙所耗用的锌和稀硫酸是否相同?为什么?
②丙同学认为在上述两种方案中,即使充分反应一段时间,所制得的铜仍混有杂质难以保证纯度,应对上述两种方案加以完善。你是否赞同丙同学的看法?为什么?你认为应怎样补充完善甲、乙两个实验方案?
 17.__________
17.__________
18.(1)
(2)
19.Ⅰ某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 、 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
Ⅱ.为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
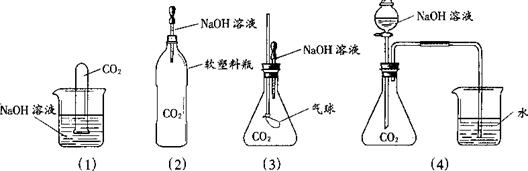
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_________________ __________________________________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是_________________________________________________________________________。
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。
20.(10分)铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。填写下列空白:
(1)配制实验用的溶液。要配制200mL密度为1.2g·cm-3的溶质质量分数为16%
的NaOH溶液,需要称取 gNaOH固体。
(2)把铝片浸入热的16%NaOH溶液中约半分钟左右洗去油污,除去表面的氧化
膜,取出用水冲洗。写出除去氧化膜的离子方程式 。
(3)如图,组装好仪器,接通开关K,通电约
25min。在阳极生成氧化铝,阴极产生气体。写出
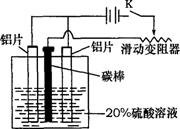 该过程中的电极反应式:
该过程中的电极反应式:
阳极
阴极
(4)断开电路,取出铝片,用1%稀氨水中和表面
的酸液,再用水冲洗干净。写出该过程发生反应的
离子方程式
21.(8分) 元素周期表是20世纪科学技术发展的重要理论依据之一。2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第 周期。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在元素周期表中的位置应该是 ;“元素” NH4的单质常温常压下应为 (填“高”或“低”)熔点 (填“固”、“液”或“气”)体, (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水,“元素” NH4与氯元素形成的化合物为 (填“离子化合物”或“共价化合物”)。
22、(15分)有机物A为茉莉香型香料。

(1)A分子中含氧官能团的的名称是 。
(2)C的分子结构可表示为(其中R和R的代表不同的烃基)
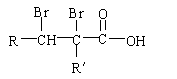
A的化学式是 ,A可以发生的反应是 (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含烃基R′的有机物
R′—OH为类别属于 。
(4)A分子结构中只有一个甲基,A的结构简式是 。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有 种。
23.纤维素是自然界最为丰富的可再生天然高分子资源。
⑴纤维素可制备用于造纸、纺织等的胶粘纤维[成分是(C6H10O5) n],生产过程涉及多个化学反应。工艺简图如下:

近来,化学家开发了一种使用NMMO加工纤维素的新方法,产品“Lyacell纤维”成份也是(C6H10O5) n。工艺流程示意图如下:
① “Lyacell纤维”工艺流程中,可充分循环利用的物质是:_________________________。
② 与“Lyacell纤维”工艺相比,粘胶纤维工艺会产生含有______(只填非金属元素符号)的废物。并由此增加了生产成本。
③“Lyacell纤维”被誉为“21世纪的绿色纤维”,原因是:_________________________。
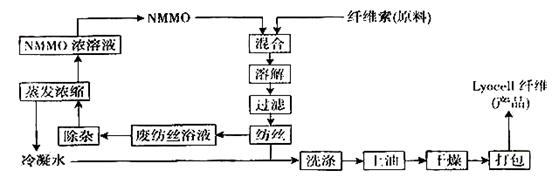
⑵“Lyacell纤维”工艺流程中的NMMO按以下合成路线制备(反应条件均省略):
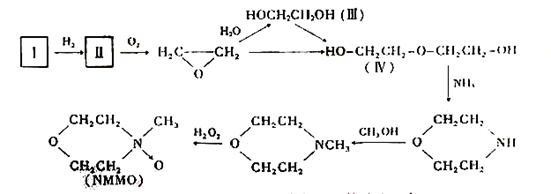
其中,化合物Ⅰ可三聚为最简单的芳香烃,化合物Ⅱ可使溴水褪色。
① 化合物Ⅰ也可聚合为在一定条件下能导电的高分子化合物,该高分子化合物的化学式为:_________________________。
② 化合物Ⅱ与O2反应的原子利用率达100%,其化学方程式为:_________。
③ 关于化合物Ⅲ、Ⅳ的说法正确的是:_________(填代号)
A.都可发生酯化反应 B.Ⅲ可被氧化,Ⅳ不可被氧化
C.都溶于水 D.Ⅲ可与钠反应,Ⅳ不可与钠反应
E.Ⅲ是乙醇的同系物 F.Ⅲ可由卤代烃的取代反应制备
④ 写出合成NMMO最后一步反应的化学方程式:
六、(本题共17分)
24、Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L硝酸恰好使混合物溶解,同时收到224mLNO气体(标准状况下)。
(1)Cu2O与稀硝酸反应的化学方程式为
__________________________________________________
(2)产物中硝酸铜的物质的量为____________。
(3)如混合物中含0.01mol Cu,则其中Cu2O和CuO的物质的量各为多少?
25硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO3+NaNO2+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
①计算吸收液中NaNO2和NaNO3物质的量之比。
②1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
高三化学第二次月考
答案:
1—-5。D. D. D. B. B. 6—10. A. B. C. D. CD
11—15. D. BD. D. BD. BC 16. D
17、(6分)(BCDGJK)(少一个扣一分,多一个倒扣一分,扣完为止)
18.(12分)(1)不相同。(2分)因为乙方案中氢气的作用除作还原剂外,还需用来排尽装置中的空气和作保护气(以防止还原出的铜被氧化),所以乙方案中耗用的氢气多,所耗用的锌和稀硫酸就多。(3分)
(2)同意丙同学的看法。(2分)因为甲方案制得的铜中可能混有锌且过滤后未洗涤,而乙方案中可能混有CuO。(2分)改正方法是:“充分反应后再加过量稀硫酸,不断搅拌,充分反应后静置、过滤并洗涤烘干。”(3分)
(若甲、乙方案分别完善且正确也给分,只完善一个方案且正确给2分)
19. Ⅰ(1)硫酸溶液、氢氧化钾溶液、1:4(每空2分)
Ⅱ(1)气球变大;CO2与NaOH反应,使试管内压强减小.
(2)上述四种装置只能说明CO2减少(也可能是CO2溶解于水所致),并不能说明CO2一定和NaOH反应.
(3)取上述实验后的液体,滴加CaCl2溶液,若出现白色沉淀,说明原实验中生成了CO32-,即CO2和NaOH混合后产生的新物质,发生了化学反应.
20.(10分)(1)38.4(2分)
(2)Al2O3+2OH-+3H2O=2[A1(OH)4]-或Al2O3+2OH-=2AlO2-+H2O(2分)
(3)2Al+3H2O→Al2O3+6H++6e—(2分) 6H++6e—→3H2↑(2分)
(4)NH3·H2O+H+= NH4++H2O (2分)
21.八 (1分) 第三周期第IA族 (2分)
低 (1分) 固 (1分) 能 (1分) 易 (1分) 离子化合物 (1分)
22、(15分)(1)醛基 (2)C14H18O a (3)醇
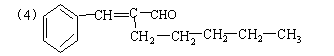
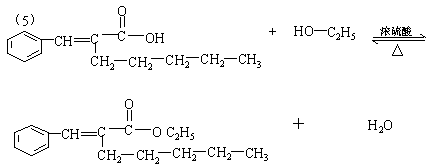
(6)3
23、(1)①NMMO ②S 、C ③副产物不会造成环境污染
![]() (2)①(C2H2)n ②2CH2===CH2 + O2
(2)①(C2H2)n ②2CH2===CH2 + O2![]() 2CH2- CH2 ③ACF
2CH2- CH2 ③ACF
O
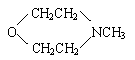 | |||
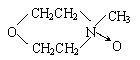 | |||
④
+ H2O2 ![]() + H2O
+ H2O
24、(1)略 (2)0.025mol (3)0.005mol 0.005mol
25.(1)48
(2)m(Na2CO3·10H2O) = 572g
(3)①2NO2+Na2CO3→NaNO2+NaNO3+CO2↑△m=48g
NO+NO2+Na2CO3→2NaNO2+CO2↑△m=32g
设由NO2与纯碱反应产生的CO2为amol 由NO和NO2与纯碱反应产生的CO2为bmol
![]()
n(NaNO2)︰n(NaNO3) = 5︰3
②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol
据Na+守恒:5x+3x=4
x=0.5
m(NaNO2)=172.5g,m(H2O)余=1000×78.8%-688=100g
析出:m(NaNO2)(最大)=172.5-71.2=101.3g