联合考试
高考理科综合试题(化学部分)
可能用到的相对原子质量:H—1 O—16 Cl—35.5 C—12 N—14 Fe—56
一、选择题(每小题只有一个正确选项,每题6分,共78分)
6.物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是 ( )
A.④⑤⑥ B.②⑤⑥ C.①②③⑤ D.①②⑤
7.设NA表示阿伏加德罗常数。下列说法正确的是 ( )
A.100mL 0.1mol·L—1 NH4Cl溶液中含NH4+数为0.01NA
B.3.5g![]() 原子中所含中子数为1.7NA
原子中所含中子数为1.7NA
C.标准状况下,22.4L戊烷所含分子数为NA
D.30g 甲醛与乙酸混合物中所含原子数为4NA
8.下列说法正确的是 ( )
①水在反应中作氧化剂时1mol水只能得到1mol电子
②保持温度不变,在Na2CO3的不饱和溶液中加Na2CO3粉末使c(Na+)/c(CO32—)比值减小
![]() ③
在NaOH溶液中水解,1摩尔该物质只消耗1mol NaOH
③
在NaOH溶液中水解,1摩尔该物质只消耗1mol NaOH
④pH相同,体积相同的盐酸和醋酸分别与锌粉反应,则在单位时间内后者得到的氢气多
A.①④ B.①②③ C.②④ D.①②
9.大101 kPa时燃烧1 t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106kJ的热量,表示上述反应的热化学方程式正确的是 ( )
A.4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g);△H=+853.7kJ·mol—1
B. FeS2(s)+11/4O2(g) 1/2Fe2O3(s)+2SO2(g);△H=-853.7kJ·mol—1
C.4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g);△H=+3414.8kJ·mol—1
D.FeS2(s)+11/4O2(g) 1/2Fe2O3(s)+2SO2(g);△H=-3414.8kJ·mol—1
|
|
|
11.环己烷有两种立体结构,船式环己烷( )和椅式环己烷( )。如果环己烷分子中有两个不同碳上的氢原子被氯原子取代,考虑环己烷的船式椅式结构,应有同分异构体 ( )
A.9种 B.6种 C.12种 D.18种
12.下列反应的离子方程式正确的是 ( )
A.用氯化铁腐蚀印剧线路铜板 Fe3++Cu=Fe2++Cu2+
B.Ca(HCO3)2溶液中滴加少量的NaOH溶液 Ca2++2HCO3—+2OH—=CaCO3↓+2H2O+CO32—
C.向溴化亚铁溶液中通入过量的氯气 2Fe2++Cl2 2Fe3++2Cl—
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液
NH4++Al3++2SO42—+2Ba2++5OH— AlO2—+2BaSO4↓+NH3·H2O+2H2O
13.甲、乙、丙、丁四位学生对发现H3分子的认识,正确的是 ( )
A.甲认为发现H3分子是不可能的,因为违背了共价键理论
B.乙认为宇宙中还存在另一种氢单质,理由是氢有三种同位素,必然有三种同素异形体
C.丙认为上述发现的存在,证明传统的价键理论有一定的局限性,理论有待于进一步发展
D.丁认为H3分子实质上是H2分子与H+以共价键形式结合的产物,应该写也H3+
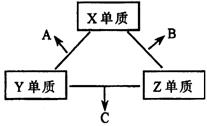
|
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是 周期 族。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式) 。
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a. 达到化学平衡时,正反应速率与逆反应速率相等
b. 反应过程中,Y单质的体积分数始终为50%
c. 达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d. 达到化学平衡的过程中气体平均相对分子质量减小
e. 达到化学平衡后,升高温度,C的体积分数增大
|
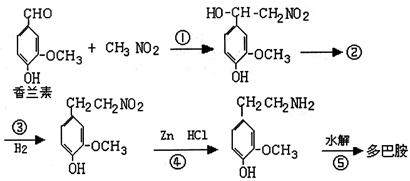
(1)多巴胺分子式: 。
(2)试判断多巴胺应具有的化学性质( )
A.加成 B.取代 C.氧化 D.水解
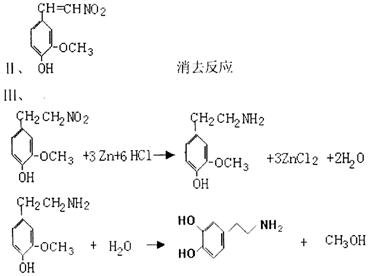
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得。合成过程表示如下:
|
Ⅰ、反应①属于 反应类型,反应原理是:
。
Ⅱ、②的结构式是: 生成②的反应类型: 。
Ⅲ、写出④、⑤步的化学方程式:
④ 。
⑤ 。
|
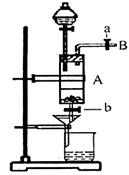
试剂。同学们利用废铁屑(含少量铜杂质)来探究
制备FeCl3·6H2O的方法,同学甲设计的实验装置
如图所示,其实验步骤如下:A中放有废铁屑,烧
杯中盛有过量的稀硝酸,实验时打开a,关闭b,
用分液漏斗向A中加过量的盐酸,此时溶液呈浅绿
色,再打开b进行过滤,过渡结束后,取烧杯内溶
液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3
分解,再降温结晶得FeCl3·6H2O晶体。填写下列
|
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是
。
(2)烧杯内放过量稀HNO3的原因是 ,发生反应的离子方程式是 。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另是
。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
, 。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是 。(填序号)
①适量氯气 ②适量过氧化氢和稀盐酸
③酸性高锰酸钾溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是 。
29.(10分)120℃、101.3kPa的条件下,有2L H2O(g)、2L CO、1L CO2、0.5L O2和1L H2
组成的混合气体。现将混合气体通过分别放有足量铜粉、碳粉和氧化铜粉末的三个灼热的反应管。假设气体通过每个反应管时都能充分反应,且不论三个反应管以何种顺序排列,请回答:
(1)尾气是否有可能是单一气体? (填“可能”或“不可能”)。
(2)原气体中是否有几种或一种不可能再存在于尾气中? (填“有”或“没有”)。若有,它们或它是 。
(3)原气体中是否有几种或一种肯定存在于尾气中? 。(填“有”或“没有”)若有,它们或它是 。若没有,请解释原因
。
参考答案
|
6.D 7.D 8.C 9.B 10.B 11.C 12.D 13.C
|
(3)① 三角锥
|
![]() ②4NH3+5O2
②4NH3+5O2 4NO+6H2O ③小于 NH4++H2O
NH3·H2O+OH—
(4)a
27.(16分,每空2分)C8H11NO2 (2)ABC
|
28.(16分,每空2分)(1)废铁屑中的不溶性杂质与Fe在盐酸中构成原电池,加快了反应速率。(2)将Fe2+全部氧化成Fe3+ NO3—+4H++3Fe2+=3Fe3++NO↑+2H2O
(3)使装置内部与外界大气相通,便于A中注体流下。
(4)产生NO气体污染环境;所得的晶体不纯。(其它合理答案亦可)
(5)②;抑制氯化铁水解,防止生成氧化铁。
29.(10分,每空2分)(1)不可能。(2)有:氧气。(3)没有;因为最后的尾气有两种可能情况,可能为氧化性的水蒸气和二氧化碳,也可能为还原性的氢气和一氧化碳。