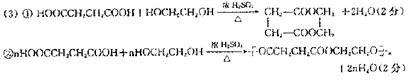高三教学情况调查化学试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分,考试用时120分钟,闭卷考试。
第Ⅰ卷(选择题74分)
可能用到的相对原子质量:H1 C12 N14 O16 S32 AI27
Cl35.5 Ca40 K39 Cu64 Fe56
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.1993年的世界10大科技新闻称,中国学者徐志傅和美国科学家穆尔共同合成了世界上最
大的碳氢分子,其中一个分子由1134个碳原子和1146年氢原子构成。关于此物质,下列
说法错误的是 ( )
A.属于烃类化合物 B.具有类似金刚石的硬度
C.在常温下呈固态 D.能在空气中燃烧
2.下列关于“生活中的化学”的叙述中不正确的是 ( )
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,立即喝牛奶或生蛋清进行解毒
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.新居室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染室内空气
3.下列有关金属元素特征的叙述正确的是 ( )
A.金属元素的原子只有还原性而离子只有氧化性
B.金属元素的音质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.金属元素在化合物中一定显正价
4.美国《科学》杂志评出了2001年十大科技成就,名列榜首的是纳米电子学,其中美国的
IBM公司科学家制造了第一批纳米管晶体管,发明了利用电子的波性来传递信息的“导
线”。已知纳米材料是指微粒直径在1~100nm的材料。下列叙述正确的是 ( )
A.纳米碳管是一种新型的高分子化合物
B.纳米碳管的化学性质稳定
C.纳米碳管导电属于化学变化
D.纳米碳管的结构和性质与金刚石相同
5. 世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保
鲜、饮用水消毒等方面有着广泛应用。则二氧化氯 ( )
A.是强氧化剂 B.是强还原剂
C.是离子化合物 D.分子中氯为负1价
6.向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴加几滴新制氯水后,混合液变成
血红色,则下列结论中错误的是 ( )
A.该晶本中一定含有SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
7.某同学设计实验证明NaOH溶液能使酚酞试液变红是OH-的性质,其中没有意义的是( )
A.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色
C.向滴有酚酞的25.0mL 0.10mol·L-1盐酸中,逐滴加20.0mL 0.10mol·L-1
NaOH溶液,观察溶液颜色的变化
D.向滴有酚酞20.0 mL 0.10mol·L-1NaOH溶液中,逐滴加25.0mL 0.10mol·L-1
盐酸,观察溶液颜色的变化
8.A、B两个烧杯中分别盛80mL 3.0mol·L-1的盐酸和氢氧化钠溶液,再分别加入等质量的铝
粉,在相同状况下产生气体的体积比为A:B=2:5,则加入铝粉的质量为 ( )
A.2.7g B.6.48g C.5.4g D.4.05g
二、选择题(本题有10小题,每小题5分,共50分,且每小题有一个或两个正确选项;漏
选得2分,多选、错选不得分)
9.下列物质与HNO3反应时,HNO3既表现强氧化性又表现酸性的是 ( )
A.FeO B.CuO C.C D.Cu
10.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.常温时,1Lmol·L-1的醋酸溶液中,所含分子总数为NA
B.1molCO2的质量与NA个CO2分子的质量之和相等
C.4g金属钙变成钙离子时失去的电子数为0.2NA
D.标准状况下,11.2L氢气与氦气所含原子数都约为NA
11.化合物甲、乙丙有如下反应转化关系
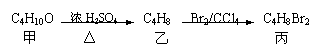
丙的结构简式不可能是 ( )
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
12.下列离子方程式书写正确的是 ( )
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合
Ba2++2OH-+2HCO3-====BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH溶液混合
NH4++HCO3-+2OH-====NH3·H2O+ CO32-+ H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2Al3++3SO2-4+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
13.下列叙述正确的是 ( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.相同物质的量浓度,相同体积的强酸与强碱溶液混合,反应后pH=7
C.原子失去电子所形成的离子,不一定具有稀有气体的电子层结构
D.某元素在化学变化中由化合态变为游离态,不能确定该元素一定被还原
14.已知:2H2(g)=O2(g)====2H2O(l) △H=-571.6kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) △H=-282.8kJ·mol-1
O2(g)===CO2(g) △H=-282.8kJ·mol-1
现有CO、H2和CO2组成的混合气体67.2L(标准状况)经完全燃烧后放出的总热量为710.0kJ,并生成18g液态水。则燃烧前混合气体中CO的体积分数为 ( )
A.80% B.50% C.60% D.20%
15.在密闭容器中能入A、B两种气体,在一定条件下反应:
![]() 2A(g)+B(g)
2C(g) △H<0
2A(g)+B(g)
2C(g) △H<0
达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是 ( )
|
|
16.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
Cd+2OH-—2e-===Cd(OH)2,
2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是 ( )
下列说法不正确的是 ( )
A.电池的总反应式是cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的正极连接
17.对复杂的有机物的结构,可以“键线式”简化表示。如有机物CH2=CH—CHO可以简写
|
|
成 。现有键线式为 的物质,它的同分异构体中属于酚类的结
构有
A.6种 B.7种 C.8种 D.9种
18.已知相同条件时碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是( )
A.少量CO2通入NaAlO2溶液中,肯定有CO32-生成
B.含CO32-的溶液容易使Al(OH)3溶液变成AlO2-
C.HCO3-只能跟Al3+反应而不能和AlO2-反应
D.NH4+、AlO2-和HCO3-能大量共存于同一溶液中
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共19分)
19.某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种。请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
| 方案 | 操作过程 | 现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
|
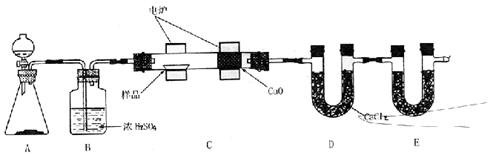
回答下列问题:
①A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式:
。
②C装置(燃烧管)中CuO的作用是 。
③写出E装置中所盛放物质的名称 ,它的作用是
。
④若将B装置去掉会对实验结果造成什么影响? 。
⑤若准确称取1.20g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为 。
⑥要确定该有机物的化学式,还要 。
四、(本题包括2小题,共18分)
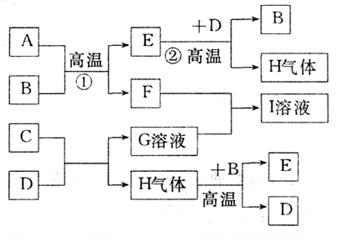
|
试回答:
(1)写出化学式:B 、C 。
(2)写出反应①②的化学方程式:
① ;
② ;
(3)A与G溶液反应的离子方程式:
。
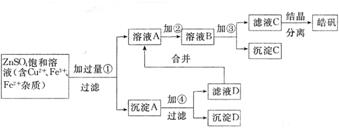
22.某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
|
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7~3.7 Fe(OH)2 : 7.6~9.6 Zn(OH)2 : 5.7~8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,其目的是
。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝
酸等,应选用 ,其理由是 。
(3)加入试剂③的目的是 。
五、(本题包括2小题,共20分)
23.本题共有三小题:
(1)烯烃、CO和H2在催化剂作用下生成醛的反应充称为烯烃的醛化反应。由乙烯制丙醛
![]()
的反应为:CH2=CH2+CO+H2 CH3CH2CHO
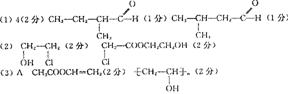
试分析由分子式为C4H8的烯烃进行醛化反应后生成的醛可能的结构简式有
种。请写出醛(有一个支链)可能的结构简式
。
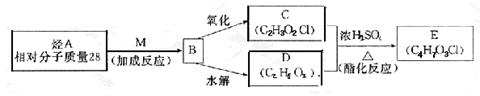
(2)已知物质M是氯气与水反应的产物之一。烃A在一定条件下有如下转化:
|
写出下列物质的结构简式:
B ;E 。
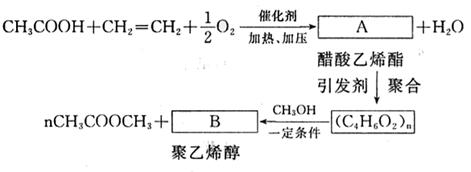
(3)纪念邮票背面刷的一层胶,主要原料是聚乙烯醇,它的生产过程简单表示如下:
|
写出下列物质的结构简式:
A ;B 。
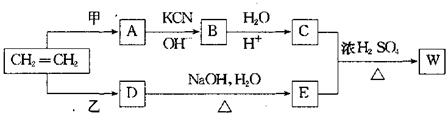
24.卤代烃R—Cl在一定条件下可发生如下反应:
R—Cl+KCN→R—CN+KCl
R—CN+2H2O+H+→R—COOH+NH4-
以乙烯为原料经过下图所示的反应可制取有机物w(A、B、C、D、E均为烃的衍生物)
|
(1)若甲为Cl2,乙为HCl,生成物W的分子式为C8H14O4,则W的结构简式为
。
(2)若W的分子式为C5H10O3,则甲为 ,乙为 。
(3)若甲、乙均为Cl2,按下列要求写出C+E→W的化学方程式:
①W为最小环状分子 。
②W为高分子 。
六、(本题包括2小题,共19分)
25.本题相对分子质量用以数据:
Na2O 62.0 Na2O2 78.0 NaOH 40.0
(1)Na2O和Na2O2的混合物140mg和足量水作用,得到400mL溶液,其中含溶质160mg。
试计算原混合物中Na2O2的质量和所得溶液在常温下的pH。
(2)若Na2O和Na2O2的混合物质量为Wg ,和足量水作用后得到的溶液中,所含溶质
的质量较原混合物增加了Xg 。试写出X的数值大小范围(以含W的代数式表示
之):
。
26.将n mol木炭粉和1 mol氧化亚铁在反应器中混合,隔绝空气加强热。
(1)可能发生的化学反应有:
①2FeO+C====2Fe+CO2↑
②FeO+C====Fe+CO
③FeO+CO====Fe+CO2↑和④ 。
(2)若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
(3)若n>4,充分反应后,反应器中的固体物质是 ,气体产物
是 。
(4)若反应的气体产物是混合物,n的取值范围是 。
(5)若反应的气体产物是混合物,且混合物中CO与CO2物质的量之比为2:1,则n的
值为 。
化学试卷参考答案
第Ⅰ卷(选择题74分)
一、二选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 | B | A | D | B | A | B | C | C |
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AD | BC | B | C | CD | B | AC | CD | D | A |
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共19分)
10.(8分)
| 方案 | 操作过程 | 现象和结论 |
| ① | 用洁净的铂丝分别蘸取固体样品在火焰上灼烧 | 焰色呈黄色,原样品为Na2SO4 |
| ② | 分别取少量固体放入式管中加热 | 固体逐渐变少而消失,原样品为NH4Cl |
| ③ | 分别取少量固体放入试管加适量蒸馏水溶解,用pH试纸测试 | 溶液pH小于7,原样品为NH4Cl |
| ④ | 分别取少量固体放入试管,加适量水溶解再滴加入BaCl2溶液 | 产生白色沉淀,原样品为Na2SO4 |
(每一方案过程、现象和结论均正确得2分。其它方案合理,现象和结论正确同样给分)
![]() 20.(11分)
20.(11分)
①H2O2(或双氧水)(1分)2 H2O2 2H2O+O2↑
②使有机物充分氧化生成CO2和H2O(1分)
③碱石灰或氢氧化钠(1分)吸收CO2气体(1分)
④造成测得有机物中含氢量偏高。(1分)
⑤CH2O(2分) ⑥测出有机物的相对分子质量。(2分)
(注:书写化学方程式化学式错误不得分,反应条件及气体符号漏写扣1分,示配平扣1
分。下同。)
四、(本题包括2小题,共18分) 21.(10分)
(1)Fe3O4(2分)、Na(2分)
![]() (2)①8Al+3Fe3O4
9Fe+4Al2O3(2分)
(2)①8Al+3Fe3O4
9Fe+4Al2O3(2分)
②3Fe+4H2O Fe3O4+4H2(2分)
③2Al+2OH-+2H2O===2AlO2-+3H2↑(2分)
22.(8分)
(1)Zn(1分);将Cu2+、Fe3+、Fe2+杂质离子除去(或除去杂质离子)(1分)
(2)H2O2(2分);作氧化剂,又不带入其他杂质(2分)
(3)调节溶液的pH(2分)
|
24.(8分)
(1)C2H5OOCOCCH2CH2COOC2H5(2分)
|
(注:有机物结构简式写错、产物水漏写不得分,反应条件漏写或未配平扣1分。)
六、(本题包括2小题,共19分)
25.(9分)
Na2O+H2O===2NaOH
2 Na2O2+2H2O===4NaOH+ O2↑
设Na2O、Na2O2、的物质的量分别为x、y。
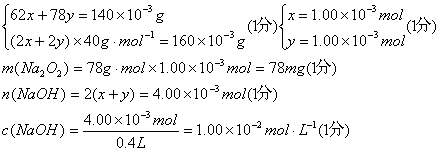
![]() pH=12(1分) 答:略。 (2)
pH=12(1分) 答:略。 (2)![]() (3分)
(3分)
![]() 26.(10分)(1)C+CO2
2CO(2分)
26.(10分)(1)C+CO2
2CO(2分)
(2)Fe、FeO(或名称)(1分。全对才得1分,下同);CO2(1分)
(3)F e、C(1分);CO(1分)
(4)![]() (2分)
(2分)
(5)![]() (2分)
(2分)