高三年级第四次月考化学试卷
化 学 试 题
说明:本试卷分为第Ⅰ卷和第Ⅱ卷。第Ⅰ卷为选择题,第Ⅱ卷为非选择题。第Ⅰ卷答填在答案表中,第Ⅱ卷答在试题卷上。本试卷满分110分,时间100分钟。
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 Al:27 S:32 Fe:56 Cu:64 Ag:108
第Ⅰ卷(选择题,共52分)
一、选择题(每小题仅有1个选项最符合题意,每小题2分。)
1,工业冶炼钨采取的方法是( )
(A) 热分解法 (B) 还原法
(C) 电解法 (D) 自然界存在直接得到
2,某些化学试剂可用于净水,水处理中使用的一种无机高分子混凝剂的化学式表示为[Al2(OH)nClm·yH2O]x,式中m等于( )
(A) 3-n (B) 6-n (C) 6+n (D) 3+n
3,下列反应的离子方程式正确的是 ( )
(A) 硫酸铝溶液与氢氧化钡溶液: Fe3+ + 3OH- == Fe(OH)3↓
(B) 硫化钠溶液与氯化钡溶液: 2Fe3+ + 3S2- == Fe2S3
(C) 过量的铁与很稀的硝酸溶液反应无气体放出:
4Fe + 10H+ + NO3- == 4Fe2+ + 3H2O + NH4+
(D) 硫化氢气体通入氯化亚铁溶液: H2S + Fe2+ == FeS↓+2H+
4,下列反应原理不符合工业冶炼金属实际情况的是( )
(A) 2HgO====2Hg+O2 (B) 4Al+3MnO2====2Al2O3+3Mn
(C) 2MgO====2Mg+O2 (D) 4CO+Fe3O4====3Fe+4CO2
5、用铁片与稀H2SO4反应制取H2 时,下列措施不能使H2速率加快的是 ( )
(A) 对反应的体系进行加热 (B) 将稀H2SO4改用98%的浓H2SO4
(C) 滴加少量的CuSO4溶液 (D) 不用铁片,改用铁粉
6、下列有关合成氨工业叙述可用勒夏特列原理来解释的是 ( )
(A) 使用铁触煤,使N2和H2混合气体有利于合成氨
(B) 高压比常压更有利于合成氨
(C) 500℃左右比室温更有利于合成氨
(D) 合成氨时采用循环操作,可提高原料的利用率。
![]() 7、在密闭容器中发生以下反应:aX(g)+bY(g)
cZ(g)+dW(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
7、在密闭容器中发生以下反应:aX(g)+bY(g)
cZ(g)+dW(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
(A) 平衡正向移动 (B) a + b > c + d
(C) Z的体积分数变大 (D) X的转化率变小
8、下列叙述正确的是 ( )
(A) 固体氯化钠不导电,所以氯化钠是非电解质
(B) 铜丝能导电,所以铜是电解质
(C) 氯化氢水溶液能导电,所以氯化氢是电解质
(D) 五氧化二磷溶于水能导电,所以五氧化二磷是电解质
二、选择题(每小题有1-2个选项符合题意,每小题3分。)
9、若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是 ( )
(A) NH4+、NO3-、CO32-、Na+ (B) Na+、Ba2+、Mg2+、HCO3-
(C) NO3- 、Na+、K+、Cl- (D) NO3-、 K+、 AlO2-、OH-
10、将m gFe2O3和FeS组成的混合物溶解在足量的盐酸中,结果得到n g沉淀,则原混合物中FeS的质量为 ( )
(A) 5n g (B) (m-5n)g (C) (m-1/4n)g (D) 11n/4g
11、一定量的Mg和MgO的混合物投入100ml 2mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是 ( )
(A) 100ml (B) 50ml
(C) 25ml (D) 由于Mg、MgO的质量未知无法判断
12、下列叙述中正确的是 ( )
(A) 含金属元素的离子不一定都是阳离子
(B) 在氧化还原反应中,非金属单质一定是氧化剂。
(C) 某元素从化合态变为游离态时,该元素一定被还原。
![]() (D) 金属阳离子被还原不一定得到金属单质
(D) 金属阳离子被还原不一定得到金属单质
13、已知723K时,2SO2(g)+O2 2SO3(g);ΔH= -393.2kJ/mol,在该温度下,向一有固定容积的密闭容器中通入2molSO2和1molO2,达到平衡时放出的热量为Q1,向另一体积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2,则下列判断不正确的是 ( )
(A) 反应速率V(SO2):第一种情况比第二种情况大
(B) 达到平衡时SO2的转化率:第一种情况比第二种情况大
(C) 达到平衡时混合气体的密度:第一种情况比第二种情况大
(D) 两种情况下平衡时放出的热量分别为:Q1=393.2kJ;Q2=196.6kJ
14、人体正常的血红蛋白中含有Fe2+,若误服NaNO2,则导致血红蛋白中Fe2+转变为高铁血红蛋白而中毒。服用维生素C可解除NaNO2中毒。下列有关叙述正确的是 ( )
(A) NaNO2是还原剂 (B) 维生素 C是氧化剂
(C) 维生素C将Fe3+还原为Fe2+ (D) NaNO2被氧化
15、某学生在实验室用CO还原CuO制Cu所用CuO为80g,则预先应准备CO的量(标准状况)应为 ( )
(A) 22.4L (B) 28g (C) 大于22.4L (D) 大于28g
![]() 16、将1molCO和1molH2O(g)充入某固定容积的反应器中,在一定条件下,当反应CO(g) + H2O(g)
CO2(g) + H2(g) 达到平衡时,此时有2/3的CO转化为CO2,在相同条件下,将1molCO2,1molH2和1molH2O(g)充入同一反应器中,当它达到平衡后混合气体中CO2的体积分数可能为 ( )
16、将1molCO和1molH2O(g)充入某固定容积的反应器中,在一定条件下,当反应CO(g) + H2O(g)
CO2(g) + H2(g) 达到平衡时,此时有2/3的CO转化为CO2,在相同条件下,将1molCO2,1molH2和1molH2O(g)充入同一反应器中,当它达到平衡后混合气体中CO2的体积分数可能为 ( )
(A) 22.2% (B) 28.2% (C) 33.3% (D) 37.8%
17、W g镁和铝的混合物,跟足量的稀硫酸反应产生的H2体积是等质量该混合物跟足量烧碱溶液反应产生H2体积的4倍(相同状况),则原混合物中镁和铝的质量比为 ( )
(A) 4:1 (B) 2:3 (C) 5:2 (D) 1:4
18、为除去镀在铝表面的铜层,可选用的试剂是 ( )
(A) 稀硝酸 (B) 浓硝酸 (C) 浓硫酸 (D) 浓盐酸
19、在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中,加入铁粉,经反应后未见气体放出,当析出3.2gCu时,溶解的铁粉的质量是 ( )
(A) 5.6g (B) 2.8g (C) 14g (D) 8.4g
20、工业上用氨和二氧化碳反应合成尿素:CO2+2NH3==CO(NH2)2+H2O,已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用,若从充分利用原料的角度考虑,选用( )作原料较好。
(A) CO (B) 石脑油(C5H12,C6H14) (C) CH4 (D) 焦炭
高三年级第四次月考试卷
化 学 答 卷
第Ⅰ卷(选择题,共52分)
一、选择题(每小题2分,共16分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、选择题(每小题3分,共36分)
| 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 |
第Ⅱ卷(非选择题,共58分)
三、填空题:(28分)
21、某无色透明溶液与金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH -、NO3-,何者能存在于此溶液中?
(1) 当生成Al3+时,可能存在______________________________________。
(2) 当生成AlO2-时,可能存在_____________________________________。
22、从金矿中提取金,传统的方法是用氰化提金法。氰化提金法的原理是:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的物质 Na[Au(CN)2],试写出该过程的化学方程式_________________________________________________________________________________________;然后再用锌从溶液中把金置换出来(提示:锌元素以[Zn(CN)4]2 - 存在于溶液中),试写出该过程的化学方程式
______________________________________________________________________。
23、超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下,生命作代谢过程产生的超氧离子(O2-)才不致过多积存而毒害细胞使人过早衰老。
|
![]() __ O2- + __
__ O2 + __ H2 O2
__ O2- + __
__ O2 + __ H2 O2
(2) 含有SOD的浓度为c0 (E)=0.400×10-6 mol/L,pH=9.1溶液中,对该反应进行研究,在常温下测得不同超氧离子的起始浓度c0(O2-)下,超氧化物歧化反应的起始反应速率Vo如下:(mol·L-1·s-1)
| c0(O2-) (mol/L) | 7.96×10-6 | 3.33×10-5 | 2.00×10-4 |
| V0 (mol·L-1·s-1) | 3.85×10-3 | 1.67×10-2 | 0.100 |
已知该歧化反应在常温下的速率方程可表示为:Vo =k [c0(O2-)]n。试根据测定数据确定歧化反应的反应级数:
n= ,化学反应速率常数k=_____________。
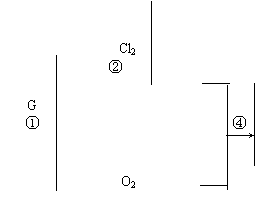
24、黑色固体A,有以下转化关系(反应条件及生成的水已略去),其中C、F在常温下为无色气体,D、E有共同的阳离子。
(1) 写出B、C的化学式:B ____ ,C _ ______ 。
(2) 写出反应②的离子方程式______________________________________________。
(3) 写出反应④的离子方程式_______________________________ _____ ___。
 ─→ D
─→ D
→ B ——─→
─→ E ─→ B
A ──→
─→ G
|
四、实验题(15分)
25、 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
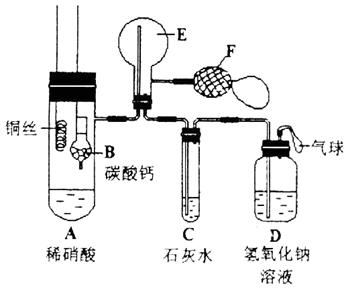 |
(1) 实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为____________________________________________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为____________________________________________________。
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是________________________________________________________________________________________________________。 一段时间后,C中白色沉淀溶解,其原因是___________________________________________________________________________________________________。
(3)装置D的作用是_______________________________________________________。
五、计算题(15分)
![]()
![]() 26、2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g) 2H2(g) + O2(g),2CO + O2(g) 2CO2(g)。
26、2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g) 2H2(g) + O2(g),2CO + O2(g) 2CO2(g)。
(1) 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 __ 和 _ ,或 _ 和 。(填各物质化学式)
(2) 若平衡时n(O2)平 == a mol,,n(CO2)平 == b mol,试求:
n(H2O)平 == (用含a、b的代数式表示)