高三年级化学测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟
可能用到的原子量:H:1 O:16 C:12 S:32 Ca:40 Na:23 P:31 Cu:64
第Ⅰ卷(选择题,共74分)
一、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列叙述中正确的是
A、分子晶体中可能不存在化学键;B、离子晶体中只存在非极性键;
C、原子晶体中只存在非极性键; D、金属的硬度均很大;

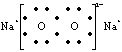 2.下列表达式错误的是
2.下列表达式错误的是
A、过氧化钠的电子式:
B、硫离子的结构示意图:
C、乙烯的结构简式:CH2CH2
D、溶液中电离方程式: HCO3-+H2O
CO32-+H3O+
3.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是 ( )
| ① | ② | ③ | ④ | ⑤ | |
| 甲 | 物质微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 溶液的质量百分比浓度 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
A.②③④ B.③④⑤ C.③④ D.③
4.对于非典型肺炎病人住过的房间,可用15%的过氧乙酸(![]() )溶液按7mL/m3
)溶液按7mL/m3
熏蒸2小时进行消毒。下列有关过氧乙酸的叙述错误的是
A、常温下其水溶液有酸性 B、具有氧化性
C、属于烃的衍生物 D、是非电解质
5. 下列实验操作会引起测定结果一定偏高的是
A.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B.用湿润的pH试纸测定溶液的PH
C.为了测定一包白色粉末的质量,将药品放右盘,砝码放左盘,并需移动游码使之平衡
D.装待测液的滴定管用水洗后,没用待测液润洗2-3次
6.最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是
A.是氢的一种新的同素异形体 B.是氢的一种新的同位素
C.它的组成可用H3表示 D.它比一个普通H2分子多一个氢原子核
7.下列说法正确的是 ( )
![]() A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
气体的颜色比原平衡颜色深
B.室温下,Ph=7的(NH4)2SO4溶液中,C(NH4+)=C(SO42-)
C.加入浓硝酸,可加快Zn与稀盐酸反应制氢气的反应速率
D.0.1 mol·L-1醋酸溶液中加入少量醋酸钠晶体后,溶液的导电性减弱
|
下列有关说法,正确的是 ( )
①Vc能够发生加成、酯化等反应 ②Vc可看做某
物质的一种自身酯化产物(内酯) ③Vc本身并
不具有酸性,它显示酸性是因为发生了水解
④Vc从形式上看,可在一定条件下转化为葡萄糖酸
A.①②③ B.①②④ C.②③④ D.全部
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.下列有关物质的性质的判断正确的是
A、水中的溶解性:C2H5Br>C2H5OH B、沸点:HF>HCl
C、熔点: 金刚石> C60 D、氧化性:O2>O3
10.在硫酸的工业制法中,下列生产操作与主要原因二者都正确的是
A、硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B、接触室中两层催化剂之间装上热交换器,加热炉气并冷却反应后生成的气体
C、SO2氧化为SO3时需要用催化剂,这样可以提高SO2的转化率
D、SO3用98%的浓H2SO4吸收,以防止形成酸雾,以便使SO3吸收完全
11.甲乙两杯醋酸稀溶液,甲的PH=a;乙的PH=a+1,下列判断正确的是
A、甲由水电离出来的H+浓度是乙的1/10倍;
B、物质的量浓度是V甲=10V乙;
C、中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,C甲>10C乙;
D、甲中的OH-离子浓度为乙中OH-离子浓度的10倍;
12.某无色溶液中,不能大量共存的离子组是
A、Ba2+、K+、I-、OH; B、Cu2+、K+、SO42-、NO3-;
C、Al3+、Mg2+、AlO2-、Cl-; D、Ca2+、Na+、HCO3-、NO3-;
13.下列离子方程式书写不正确的是
A、在氢氧化钡溶液中逐滴滴加硫酸氢钠溶液至恰好中和;
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B、在苯酚钠溶液中通入少量二氧化碳;
2C6H5O-+H2O+CO2→2 C6H5OH +CO32-
C、在澄清石灰水中滴加过量碳酸氢钙溶液;
Ca2++HCO3-+OH-=CaCO3↓+H2O
D、在含0.1mol溴化亚铁溶液中慢慢通入 0.1molCl2;
2Fe2++2Br-+2Cl2=2Fe3++Br2+4 Cl-
14.某同学在一定量的稀硫酸溶液中加入一定量的其他溶液,并测定有关的实验数值数值。实验后,将有关实验数据绘制成如下图象,其中正确的是
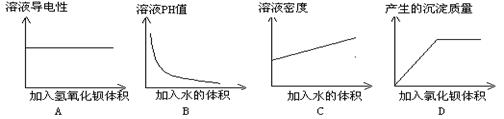
15.据已有知识和元素性质递变规律来判断下列比较不正确的是
A、第二周期氢化物易燃性:CH4>NH3>H2O;
B、第三周期氢化物稳定性:相SiH4>PH3>H2S>HCl;
C、化合物毒性:若PH3>NH3,则H2S>H2O;
D、最高价氧化物对应水化物的酸性: HClO4>HNO3>H3PO4>H4SiO4;
16.在常温下10mlPH=4的一元强酸HA中,加入PH=10的一元碱BOH溶液到PH等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A、C(H+)=C(OH-)=C(A-)=C(B+); B、C(A-)=C(B+)
C、V总≥20ml; D、 V总≤20ml;
17.设NA为阿佛加德罗常数,下列说法正确的是
A、在铁与硫的反应中,1mol铁失去的电子数为2 NA;
B、1molCH3+中含电子数为8 NA;
C、标准状况下22.4LSO3中含原子数为4 NA;
D、常温常压下11.2LCO2气体通过足量的Na2O2充分反应,转移电子数为2NA;
18.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·XCaSO4·xCu(OH)2·yCa(OH)2,此种配比当x=3时,则y为
A、1;
B、3;
C、5; D、7;
第Ⅱ卷(非选择题,共76分)
三、(本题包括两个小题,共21分)
19.已知:⑴溶液中c(OH-)10-6mol·L-1和6 mol·L-1之间,可使无色的酚酞试液呈红色;⑵过氧化氢具有漂白性。
据此回答下列问题:
现将0.39g过氧化钠粉末溶解在10mL水中,向所得溶液中加入2滴酚酞,放置片刻,红色褪去。
⑴甲同学认为红色褪去的原因是由于溶液中c(OH-)较大,此种说法
(填“正确”或“不正确”),通过估算说明理由 ;
⑵乙同学认为红色褪去的原因可能是由于反应中有过氧化氢生成,此种说法
(填“正确”或“不正确”),并通过①分析推理、②提出假设、③设计实验来说明理由。
①分析推理 ;
②提出假设 ;
③设计实验
。
20某学生拟利用下列两个在室温下能顺利进行的反应,在实验室制取少量纯净的氮气。
3Cl2+2NH3=N2+6HCl NH3·H2O(浓) NH3↑+H2O
实验时,可供选择的仪器装置如下图所示。

实验时可供选择的试剂有:①饱和食盐水,②浓硫酸,③浓硝酸,④浓盐酸,⑤稀烧碱溶液,⑥碱石灰,⑦二氧化锰粉末,⑧浓氨水。
该生设计的实验流程是:
 |
回答下列问题:
⑴在所给出的仪器装置中,要组装成制得纯净的氨的装置,按实验时装置合理连接的先后顺序应依次选取_______(填图中仪器装置的代号);制得纯净的氯气选用的试剂是_________(填试剂的编号)。
⑵利用浓氨水和氢氧化钠固体制氨时,氢氧化钠固体的作用是__________;此时若用碱石灰代替氢氧化钠,能否达到目的?_____。
⑶氯气跟氨的反应应在装置__________(填装置代号)中进行,生成的氮气中可能会混有的杂质气体有______________________;若生成的氮气中混有氯气或氯化氢气体,则净化时先后依次通过的试剂是__________(填试剂的编号)。
四、(本题包括2小题。共18分)
21.(8分)已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:
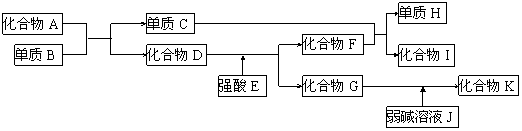
请回答:⑴写出有关物质的化学式:D是_____,H是________。
⑵写出下列反应的化学方程式:
① 化合物G的溶液不呈中性,其原因用离子方程式表示为______________
② C+F→H+I________________________________。
22.(10分)在一固定容积的密闭容器中,保持一定的温度,在一定的条件下进行以下的反应:A(g)+2B(g) ![]() 3C(g),已知加入1molA和3molB且达到平衡时生成amolC.
3C(g),已知加入1molA和3molB且达到平衡时生成amolC.
⑴达到平衡时,C在反应混合气体中的物质的量百分含量为__(用含a的关系式表示)
在相同实验条件下,若在同一容器中改为加入2molA和6molB,达到平衡后,C的物质的量为___(用含a的关系式表示),此时C在反应混合气体中的物质的量百分含量_____(填增大、减小、不变)
⑶在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后,C在反应混合气体中的物质的量百分含量不变,还应加入C___mol。
⑷若在同一容器中,加入nmolA和3nmolB,则平衡时C的物质的量为mmol。若改变实验条件,可以使C的物质的量在m~2m之间变化,那么,n的取值范围是____(用字母m、n关系式表示)。
五、(本题包括2小题,共17分)
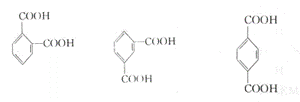
23.(9分)下列三种有机物都是某些植物挥发油中的主要成分。
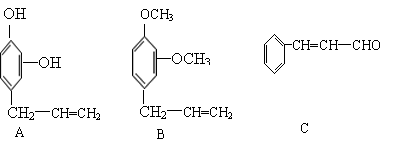 |
回答下列问题
⑴这三种有机物均属于(选填字母)______
a 芳香烃 b 酚类 c 芳香族化合物 d 醛类
⑵A能发生的反应类型(选填字母)_____
a、消去 b、与氢氧化钠溶液中和 c、加成反应 d、氧化反应
e、加聚反应 f、还原反应
⑶一定质量的有机物C,在足量的O2中完全燃烧,生成CO2和消耗O2的物质的量之比为_____
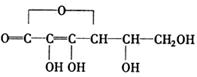
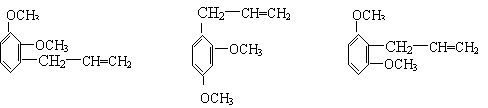
⑷B分子有多种同分异构体,其中均含有两个“—OCH3”和一个“—CH2—CH=CH2”基
团的芳香族化合物有五种,请写出其余两种的结构简式:______________、
______________________
24.已知有两种有机反应:
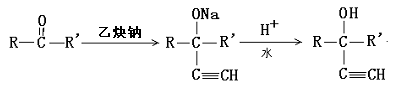 ①
①
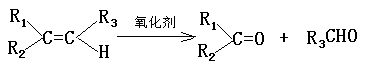 ②
②
现有化合物A的一系列反应,起始物为只有一个侧链的芳香烃(某些反应的条件已略去)
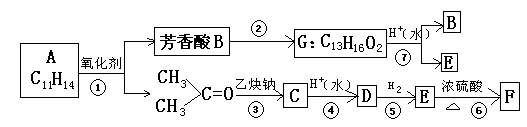
试回答:
(1)A的结构简式是
(2)反应过程中属于加成反应的是(填编号):
(3)写出下列反应的化学方程式:
B+E→G
E→F
六、(本小题包括2小题,共20分)
25.A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05mol在0.125molO2中完全燃烧生成0.1molCO2和0.1mol H2O ,通过计算回答:
(1)从分子组成的角度分析,该混合物的组合可能有几种?
(2)另取一定量的A和B的混合物完全燃烧,将其以任意比混合且物质的量和一定。
①若耗氧一定,则A和B的分子式分别是 、 。
②若生成CO2和H2O的物质的量一定,则A和B的分子式分别是 、 。
26.为了防治环境污染并对尾气进行综合处理,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成。现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4分解温度均高于200℃],测得有关数据如下(标准状况):
| 实验序号 | 样品质量/g | NaOH溶液体积/mL | 氨气体积/L |
| I | 7.4 | 40.00 | 1.68 |
| II | 14.8 | 40.00 | 3.36 |
| III | 22.2 | 40.00 | 1.12 |
| IV | 37.0 | 40.00 | 0.00 |
(1) 实验过程中有关的离子反应方程式为
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为 L
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比
(4)欲计算该NaOH溶液物质的量浓度应选择第 组数据,其浓度为 。
19.不合理。估算所得溶液中![]() 约为
约为![]() ,故在酚酞呈红色的范围内
,故在酚酞呈红色的范围内![]() 。
。
20.(12分)
⑴AG (颠倒顺序不给分)(2¹) ④⑦①②(少一个不给分)(2¹)
⑵抑制NH·HO的电离和氨的溶解,使氨从溶液中逸出。(2¹)能 (1¹)
⑶F(1¹) NH3、Cl2、HCl中的一种或Cl2和HCl(2¹)⑤②(或⑥)(2¹)
![]() 21.(8分)
21.(8分)
⑴ D是Al2O3(2¹) H是H2(2¹)
⑵①Al3++3H2O ![]() Al(OH)3-+3H+ (不用不给分。不配平或不注明反应条件或条件注明错误的只给1分,下同) (2¹)
Al(OH)3-+3H+ (不用不给分。不配平或不注明反应条件或条件注明错误的只给1分,下同) (2¹)
⑶3Fe+4H2O Fe3O4+4H2↑(2¹)
22.(10分)⑴25a%(2¹)⑵2a(2¹)不变(2¹)⑶6(2¹)⑷n>2/3m(2¹)
五、(共17分)
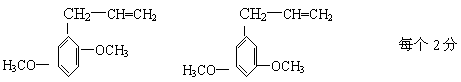 23.(9分)
23.(9分)
⑴C(1¹)⑵cdef(2¹)⑶6∶7(2¹)
⑷
(10分)取3.320 g只含羧基,不含其他官能团的固态芳香族羧酸[其表示式
为:(H2O)x(CO2)yCz]置于4.00 L氧气中,经点燃后羧酸完全燃烧,反应后气体体积
变化(增加或减少)0.224 L,将气体通过足量的固体过氧化钠后,体积减少1.792 L(所
有气体均为标准状况下测定)。请回答:
(1)3.320 g该羧酸中碳原子物质的量为 ;
(2)该羧酸中C、H、O的原子数之比为 ;
(3)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式 。
(10分)
(1)0.160 mol (2)4∶3∶2
⑶