高三年级化学学科10月份月考试题
本试卷所需的原子量:
H-1 O-16 Cl-35.5 Na-23 C-12
一、选择题(每题有一个正确的答案。请将答案填在后面的方框内)
1、据悉,用10 B合成10 B20有非常好的抗癌、治癌作用,下列说法正确的是
A.10 B 和10B20互为同位素 B.10B和10B20 互为同系物
C.10B的中子数与核外电子数相等 D.10B20是一种熔点很高,硬度很大的物质
2、已知![]() (钍)原子可发生下列放射性衰变:
(钍)原子可发生下列放射性衰变:![]()
![]()
![]() ,生成的元素与Fr(钫)处于同一周期,以下关于X的推断中错误的是( )
,生成的元素与Fr(钫)处于同一周期,以下关于X的推断中错误的是( )
(A)X的氢氧化物是一种强碱 (B)X的碳酸正盐不溶于水
(C)X的原子核外有6个电子层 (D)X的最高化合价为+2价
3、下列各项的叙述中都包含两个数值,前一数值大于后一数值的是( )
(A)单质碘中的分子间作用力和干冰中的分子间作用力
(B)NaCl晶体中与一个Cl-紧邻的Na+数和CsCl晶体中与一个Cl-紧邻的Cs+数
(C)晶体硅中Si—Si键的键能和金刚石中C—C键的键能
(D)氨分子中N—H键的键角和甲烷分子中C—H键的键角
4、某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
5、氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中错误的是
A、在CCl4中的溶解性BrCl<Br2
B.、BrCl氧化性比Br2强,比Cl2弱
C.、沸点BrCl>Br2 D.常温下BrCl可与NaOH溶液反应生成NaCl和NaBrO
6、在含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干,并将残渣灼烧,得到的残渣是
A.FeCl2、Br2、I2 B.FeCl3、I2 C.Fe(OH)3、I2 D.Fe2O3
7、今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量的NaHSO3晶体(mmol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
8、有关叙述:(1)非金属单质M能从N的化合物中置换出非金属单质N。(2)M原子比N原子容易得到电子。(3)单质M跟H2反应比N跟H2反应容易得多。(4)气态氢化物水溶液的酸性HmM>HnN。(5)氧化物水化物的酸性HmMOx>HnNOy。(6)熔点M>N。能说明M比N的非金属性强的叙述是
A.①②③ B.②③⑤ C.①②④⑤ D.全部
二、(每题有一个或两个正确的答案。请将答案填在后面的方框内)
9、下列离子方程式书写正确的是
(A)向含有0.1mol
NaOH溶液中通入3.36L(标况)![]() 气体
气体
![]()
(B)向100mL 0.1mol/L Fe![]() 溶液中通入0.025mol的
溶液中通入0.025mol的![]()
![]()
(C)硫酸氢钠与足量的![]() 溶液反应
溶液反应
![]()
(D)碳酸氢镁溶液与足量的NaOH溶液反应
![]()
10、设No为阿伏加德罗常数的值,下列正确的是
A.使Na2O2与H2O反应生成常温常压下16g的O2气体,反应中转移的电子数No
B.使22.4L的HCl气体溶于水,水中H+ 数为No
C.使1molCO2与过量NaOH溶液反应后,溶液中CO32- 个数约No
D.3g金刚石中所含有共价键数目为No
11、已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下面有关锂及其化合物性质的叙述不正确的是
A.锂在过量氧气中燃烧主要产物是氧化锂而不是过氧化锂
B.碳酸锂受强热很难分解
C.碳酸锂的溶解度比碳酸氢锂的大
D.锂可以与氮气化合生成氮化锂(Li3N)
12、m g H2和n g He的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为1∶2
13、已知甲、乙溶质质量分数与密度的关系如下表:
| 溶质质量分数 | 甲溶液密度(g/cm3) | 乙溶液密度(g/cm3) |
| 1% | 0.95 | 1.02 |
| 5% | 0.92 | 1.04 |
| 10% | 0.90 | 1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
14、1999年曾报道合成和分离了含高能量的正离子N![]() 的化合物N5AsF6,下列叙述中错误的是
的化合物N5AsF6,下列叙述中错误的是
A.N![]() 共有34个核外电子
B.N
共有34个核外电子
B.N![]() 中氮—氮原子间以共用电子对结合
中氮—氮原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+1 D.化合物N5AsF6中F的化合价为-1
15、.已知A2O![]() 可与B2-反应,B2-被氧化,产物为B单质,A2O
可与B2-反应,B2-被氧化,产物为B单质,A2O![]() 被还原,产物为A3+,且知100
mL c(A2O
被还原,产物为A3+,且知100
mL c(A2O![]() )=0.3mol·L-1的溶液与150
mL c(B2-)=0.6mol·L-1的溶液恰好完全反应,则n值为
)=0.3mol·L-1的溶液与150
mL c(B2-)=0.6mol·L-1的溶液恰好完全反应,则n值为
A.4 B.5 C.6 D.7
16、我国首创的铝—空气—海水电池被称为“海洋电池”,是一种无污染的长效电池,以铁铂合金网(接触空气)和铝分别为电池的两极放入海水中即可供电,下列反应与该电池的工作原理有关的是
① Fe-2e-===Fe2+ ②Al-3e- ===A13+ ③O2+2H2O+4e- ===4OH-
④4Al+3O2+6H2O===4Al(OH)3 ⑤2Fe+O2+2H2O===2Fe(OH)2
A.②③④ B.①③⑤ C.①⑤ D.③④
17、通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.分子中N—C1键键长比CCl4分子中C—C1键键长长
B.分子中的所有原于均达到8电子稳定结构
C.NCl3分子是非极性分子 D.NBr3比NCl3易挥发
18、下列画有横线的物质在反应中不能完全消耗的是
A.将含少量H2O(g)的H2通入盛有足量Na2O2的容器中并不断用电火花点燃
B.将l mol Cu置于含2 mo1H2SO4的浓硫酸中加热
C.在强光持续照射下,向过量的Ca(C1O)2溶液中通入少量的CO2
D.在一定条件下,3体积H2和1体积N2在催化剂存在下反应
化学学科10月份月考试题
 选择题答案:
选择题答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | ||||||||||
19、(16`)实验室配制500 mL 0.5 mol·L-1的NaC1溶液,有如下操作步骤:
①把称量好的NaC1晶体放入小烧怀中,加适量蒸馏水溶解;②把①所得溶液小心转入500 mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距刻度1 cm ~ 2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)操作步骤的正确顺序为_______ _ (填序号)。
(2)本实验用到的基本实验仪器有 。
(3)某同学俯视容量瓶刻度线滴加蒸馏水而定容,对所配溶液浓度有何影响?________(“偏高”“偏低”或“无影响”)。
(4)若出现如下情况,对所配溶液浓度将有何影响:
没有进行操作步骤④________;加蒸馏水时不慎超过了刻度________。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度 。
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面
20、(15`)某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
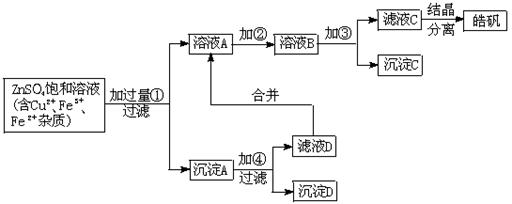
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7~3.7 Fe(OH)2:7.6~9.6 Zn(OH)2:5.7~8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,
其目的是 。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
(3)加入的试剂③是
的目的是 。
21(14`)、A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2:A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性:B与D可形成一种极易溶于水的碱性气体X,B与C可能形成极易溶于水的酸性气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的电子相等,请回答:
(1)写出四种元素的符号:A________ B________ C________ D________
(2)写出下列反应的化学方程式:
①![]() :________________________________
:________________________________
②![]() :________________________________
:________________________________
(3)B4A3D2的化学式为___________,其水溶液显酸性的离子方程式为_________________________________。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
22(14`)、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1) 通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
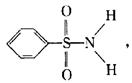
(3)某有机化合物结构式为: 其中S—N键中你认
为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
23、(8`)已知下列两个热化学方程式;
H2(g)+![]() O2(g)==== H2O(l );△H= -285.8kJ/ mol
O2(g)==== H2O(l );△H= -285.8kJ/ mol
C3H8(g)+5O2(g) ==== 3CO2(g) +4H2O(l);△H= -2220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)=H2O(g);△H=+44.0 kJ/ mol
试写出丙烷燃烧生成CO2和水蒸气热化学方程式。
24、(9`)在标准状况下,将224 L HCl气体溶于635 mL水中(ρ=1 g/cm3),所得盐酸的密度为1.18 g/cm3。试计算:
(1) 取出这种盐酸100.0 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度。
(2)在40.0 mL 0.0650 mol·L-1Na2CO3溶液中,逐滴加入(1)所配制的稀盐酸,边滴边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不能超过多少毫升?
张家港高级中学2004届高三年级化学学科10月份月考试题答案
1、 C 2、C 3、A 4、D 5、C 6、D 7、B 8、A
9、BC 10、AC、 11、BC、12、BD 13、B 14、C 15、D 16、A 17、B 18、BD
19、(1) 1、2、4、3、5
(3)偏高、
(4)偏低、偏低、
(5)重做、重做
20、(1)Zn,将Cu2+、Fe3+还原
(2)20%的H2O2,
将Fe2+氧化为Fe3+,同时不引入杂质离子
(3)ZnO或ZnCO3或Zn(OH)2,调节溶液的PH值将Fe3+沉淀
21、(1)O、H、N、Cl
22、(1)0.93-1.57 (2)2.25-3.44
(2)X越大,原子半径越小, 周期性
(3)氮
(4)共价键
(5)六-IA
23、3:2
24、1mol/L 2.6mL