高三化学试题(附中)
一、选择题(本题包括19小题,每小题2分,共38分,每小题只有一个正确答案)
1.有专家提出,如果燃料燃烧产物如CO2、H2O、N2等利用太阳能使它们从新组合,使之变成CH4、CH3OH、NH3等的构想(如图)能够实现,那么不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此过程中太阳能最终转化为\\A
![]()
|
燃料 燃烧产物
CH4 CO2
CH3OH H2O
NH3 N2
![]()
|
2.有人认为在元素周期表中,位于IA族的氢元素,也可放在ⅦA族,下列物质能支持这种观点的是\\C
A.HF B.H3O+ C.NaH D.H2O2
3.下列有关叙述错误的是
A.向碳酸钠饱和溶液中通入足量二氧化碳会出现浑浊\\B
B.碳酸钠溶液中含有少量碳酸氢钠可用加入法除去
C.碳酸氢钠溶液中含有少量碳酸钠可通入足量二氧化碳除去
D.氧化钠是典型的碱性氧化物
4.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是\\C
A.稀盐酸、Na2CO3溶液 B.氯水、FeBr2溶液
C.CuSO4溶液、Ba(OH)2溶液 D.NaHCO3溶液、Ca(OH)2溶液
5.碘和氧可以形成多种化合物,其中一种成为碘酸碘,在该化合物中碘元素呈+3和+5两种价态,这种化合物的化学式是\\D
A.I2O3 B.I2O4 C.I4O7 D.I4O9
6.下列说法正确的是\\D
A.强电解质一定属于离子化合物 B.失电子难的原子获得电子的能力一定强
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.在复分解反应中,较弱的酸与盐反应可以生成强酸
7.量筒和滴定管所盛放液体的凹面,都在10mL刻度,若都采用仰视读数,则前者比后者的读数\\B
A.大于 B.小于 C.等于 D.不能比较
8.某学生配制0.1mol·L-1的NaOH溶液100mL,下列操作会造成NaOH实际浓度偏高的是\\C
A.空盘时天平指针指向标尺左边 B.把烧碱固体放在纸上称量
C.定容时俯视容量瓶的刻度线 D.使用在空气中部分变质的NaOH
9.实验室里需要用480mL 0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是\\D
A.称取7.68g硫酸铜,加入480mL水 B.称取12.0g胆矾配成480mL溶液
C.称取8.0g硫酸铜,加入水500mL D.称取12.5g胆矾配成500mL溶液
10.等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是\\C
A.HCO3-+OH-==H2O+CO32-
B.2HCO3-+Ba(OH)2==BaCO3↓+CO32-+2H2O
C.HCO3-+Ba2++OH-==BaCO3↓+H2O
D.2HCO3-+Ba2++2OH-==BaCO3↓+CO32-+2H2O
11.NA为阿伏加得罗常数,下列叙述正确的是\\A
A.80g硝酸铵含有氮原子数为2NA B.1L 1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA C.标况下,11.2L四氯化碳所含分子数为0.5NA
D.在铜与硫的反应中,1mol铜失去的电子数为2NA
12.将Cl2与NH3混合,可以发生的反应3Cl2+8NH3==6NH4Cl+N2,关于这个反应说法错误的是\\A
A.氧化剂和还原剂的物质的量之比为3:8
B.该反应属于置换反应
C.该反应应控制NH3过量
D.该反应说明氯元素的非金属性强于氮元素
13.用来检验集气瓶中是否充满HCl气体,可用滤纸吸附下面哪种溶液放在瓶口①硝酸银②溴化钠③浓氨水④NaOH⑤硫酸铜⑥品红⑦紫色石蕊\\B
A.①③④⑦ B.只有③⑦ C.全部 D.②④⑤⑦
14.某无色透明溶液,能与铝反应放出氢气,则在此溶液中可能大量共存得离子组是\\C
A.Fe2+,Cl-,K+,Mg2+ B.Na+,Al3+,SO42-,NO3-
C.Na+,AlO2-,CO32-,NO3- D.K+,HCO3-,Cl-,F-
15.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4==3Br2+3Na2SO4+3H2O,与上述反应在原理上最相似的是\\C
A.2NaBr+Cl2==2NaCl+Br2
B.AlCl3+3NaAlO2+6H2O==4Al(OH)3↓+3NaCl
C.2H2S+SO2==2H2O+3S↓ D.2FeCl3+H2S==2FeCl2+S↓+2HCl
16.将4.3gNa,Na2O,Na2O2的混合物与足量的水充分反应后,在标况下得到672mL混合气体,将该混合气体通过放电,恰好完全反应,则它们的物质的量之比为\\D
A.1:1:1 B.1:1:2 C.1:2:1 D.4:3:2
17.有50mL某气体可能含有CO2,O2,NH3等气体,将其通过浓硫酸没有发现体积变化,通过足量Na2O2后体积变为3OmL,该气体的组成为\\D
A.CO2为4OmL,NH3为10mL B.NH3为40mL,O2为10mL
C.CO2为30mL,O2为20mL D.CO2为40mL,O2为10mL
18.某盐酸的浓度为12.0mol·L-1,其密度为1.19g·cm-3。现有该浓度的盐酸100mL,则用于吸收HCl形成该盐酸的水的体积是\\A
A.75.2mL B.85.5mL C.90.8mL D.100mL
19.用足量的MnO2与VmL 10mol·L-1的盐酸共热制取Cl2,标态下产生2.24L的Cl2.则V的取值应为\\D
A.V=20 B.V=40 C.20 <V<40 D.V>40
二、选择题(本题包括4小题,每小题3分,共12分,每小题只有一个正确答案)
20.设NA为阿伏加得罗常数,在标况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占有的体积(L)应是\\A
A.V=22.4nb/mNA L B.V=22.4mb/nNA L
C.V=22.4nNA/mb L D.V=nbNA/22.4m L
21.H2、CO和另一种气体的混合气体Ag,在足量氧气中燃烧,所得产物用过量Na2O2充分吸收,固体增重Bg,B<A,另一种气体可能是\\D
A.CH4 B.C2H2 C.HCHO D.CO2
22.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为\\D
A.21:5 B.11:3 C.3:1 D.4:1
23.实验室将NaClO3和Na2SO3按物质的量比为2:1加入烧杯中,用水浴加热,同时滴入H2SO4溶液,产生黄绿色气体X,反应后测得NaClO3和Na2SO4均无剩余,则X为\\B
A.Cl2 B.ClO2 C.Cl2O D.Cl2O3
三、实验题(本题共2小题,每小题10分,共32分)
24.(16分)下列各项内容中都缺少一项实验数据。请安要求完成
(6分)⑴在t℃、pPa时,10g A和6g B恰好完全反应,生成固体C和2L气体D。现要计算生成固体C的量,缺少的实验数据是____________。
请简述你设计测定这一数据的简要步骤:
①
②
③
![]()

![]()
![]() (10分)⑵常况下,用6.5g金属与100mL盐酸反应,现要计算生成氢气的体积,缺少的实验数据是____________________。并回答:
(10分)⑵常况下,用6.5g金属与100mL盐酸反应,现要计算生成氢气的体积,缺少的实验数据是____________________。并回答:
①在实验室,请绘制表明氢气体积的测定:
②对于缺少的数据,你要测定这一数据时,必须用到的仪器是_________________________________________,必须用到的试剂是____________________________________________________。
(上述二空缺一项判零分)
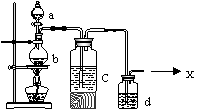 25.(16分)浓盐酸与重铬酸钾(K2Cr2O7)共热能产生某种气体单质x,产物中还有CrCl3等生成,这种方法制x时反应便于控制,加热反应进行,撤灯则反应停止,现要制取纯净的x:
25.(16分)浓盐酸与重铬酸钾(K2Cr2O7)共热能产生某种气体单质x,产物中还有CrCl3等生成,这种方法制x时反应便于控制,加热反应进行,撤灯则反应停止,现要制取纯净的x:
⑴加热时,烧杯中反应的化学方程式为___________________________;
⑵液体c的名称是__________,其作用是__________________________;
⑶液体d的名称是__________,其作用是___________________________。
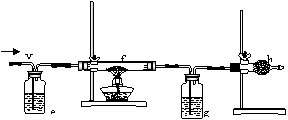 现把制得的纯净干燥的x通入下图所示的装置。
现把制得的纯净干燥的x通入下图所示的装置。
⑷e是FeBr2溶液,一段时间后观察到实验现象是______
______________________________;
⑸f是一种白色的钾盐,一段时间后观察到大试管内有紫色
气体,则大试管内的反应方程式为________________________;
⑹g是水和CCl4混合物,则看到深色液体层在_____层(填上、下);
⑺h是碱石灰,则此装置的作用是___________________________。
四、推断题(本小题共1小题,共10分)
26.(10分)用氯气对饮用水消毒已有百年历史,这种消毒方法会使饮用水中的有机物发生氯代,生成有机含氯化合物,对人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广普型高效消毒剂二氧化氯(ClO2),它是一种易爆物。
⑴使用ClO2作饮用水消毒剂的优点是:____________________________,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
⑵目前欧洲一些国家用KClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,若制备1mol的ClO2,反应中转移的电子数目约为____ 个。
⑶我国最近研究成功用氯气氧化亚氯酸钠(NaClO2)(在氮气保护下)制得ClO2.表示这一反应的化学方程式为_______________________________,这一方法的优点是:_________________________。
五、计算题(本题1小题,共20分)
27.(8分)将一定质量的Na2CO3和NaHCO3混合物加热灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到沉淀是1.0g,加热后剩余的固体物质与足量盐酸反应,收集到1.12L气体(标况),计算原混合物中Na2CO3与NaHCO3的物质的量之比。
答案
1.A 2.C. 3.B 4.C 5.D 6.D 7.B 8.C 9.D 10.C 11.A 12.A 13.B 14.C 15.C 16.D 17.D 18.A 19.D 20.A 21.D 22.D 23.B
24.⑴t℃pPa D的密度
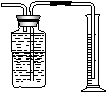 简要步骤:①称量一空烧瓶(干燥)质量(充满空气) ②通入干燥的气体D称重 ③再次操作,使两次操作称量值,基本相同 ④往烧瓶内加满水,塞好胶塞,称重
简要步骤:①称量一空烧瓶(干燥)质量(充满空气) ②通入干燥的气体D称重 ③再次操作,使两次操作称量值,基本相同 ④往烧瓶内加满水,塞好胶塞,称重
⑵盐酸的物质的量浓度 ① (其它合理答案亦可)
②酸、碱式滴定管、锥形瓶、 滴定台(铁架台)、烧杯;
标准浓度的NaOH溶液、酚酞、 蒸馏水、未知浓度盐酸。
25.⑴K2Cr2O7+14HCl![]() 2CrCl3+2KCl+3Cl2↑+7H2O
2CrCl3+2KCl+3Cl2↑+7H2O
⑵饱和食盐水,除HCl ⑶浓H2SO4,除H2O ⑷溶液由浅绿色变黄色,再变棕黄色 ⑸Cl2+2KI==I2+2KCl ⑹下 ⑺吸收多余Cl2等
26.⑴高效,且不会与有机物发生取代、加成;2.63; ⑵ 6.02×1023
⑶Cl2+2NaClO2==2ClO2↑+2NaCl 吸收率高,质量好,无Cl2杂质。
27. 2:1