高三化学试题第一学期第二次月考2
命题人 高三化学备课组
(总分:150分 考试时间:120分)
第Ⅰ卷(选择题 共72分)
一、选择题:(本题包括8小题,每小题4分,共32分;每小题只有一个选项符合题意)
1.氯化碘(ICl)的化学性质跟氯气相似。预计它跟水反应的最初生成物是
A. HI和HCl B. HCl和HIO C. HClO3和HIO D. HClO和HIO
![]()
![]() 2.下列措施能使2H2O H3O+
+OH -,电离平衡向正方向移动,且所得溶液呈酸性的是
2.下列措施能使2H2O H3O+
+OH -,电离平衡向正方向移动,且所得溶液呈酸性的是
A.向水中加小苏打 B.向水中加胆矾 C.向水中加硫酸 D.将水加热至pH=6
3.下列各物质既是电解质,同时又能导电的是
A. Cu B. 熔化的NaCl C. 98%的浓H2SO4 D. 液态氯化氢
4.有CH3COOH与CH3COONa等物质的量混合配成的溶液,pH为4.7,下列说法中错
误的是
A. CH3COOH 的电离作用大于CH3COONa的水解作用
B. CH3COONa 的水解作用大于CH3COOH的电离作用
C. CH3COOH 的存在抑制了CH3COONa的水解
D. CH3COONa 的存在抑制了CH3COOH的电离
5、若1g水中含有m个氢原子,则阿伏加德罗常数是
A. m/9 B. 9m C. 2m D. m/2
6、碳的三种同位素![]() 、
、![]() 、
、![]() 的原子,下列各项对三种原子均不同的是
的原子,下列各项对三种原子均不同的是
A.核电荷数 B. 中子数 C. 电子层数 D. 元素种类
7、在一定体积的18mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为
0.9mol,则浓硫酸的实际体积为
A. 等于50mL B.大于50mL C.等于100mL D.大于100mL
![]() 8、二氧化氮能形成二聚分子:2NO2(g) N2O4(g)正反应放热,现欲测定NO2分子
8、二氧化氮能形成二聚分子:2NO2(g) N2O4(g)正反应放热,现欲测定NO2分子
的相对质量,应采取的措施是
A.高温、低压 B.低温、高压 C.低温、低压 D.高温、高压
二、选择题:(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。只要选错一个,该小题就为零分;若正确答案包括两个选项,只选一个且正确的给2分。)
9、在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应:
![]() A(s)+ 2B(g) C(g)+ D(g)已达平衡状态的是
A(s)+ 2B(g) C(g)+ D(g)已达平衡状态的是
A. 混合气体的密度 B.混合气体的压强 C.混合气体的体积 D.C气体的物质的量
10、下列各项操作中,不发生“先沉淀后溶解”现象的是
①向饱和Na2CO3溶液中通入过量的CO2;②向Fe(OH)3胶体中逐滴滴入过量的稀
H2SO4;③向AgI胶体中逐滴加入过量的稀盐酸;④向石灰水中通入过量的CO2;⑤
向硅酸钠溶液中逐滴加入过量的盐酸。
A. ①②③ B. ②③⑤ C. ①②③⑤ D. ①③⑤
11、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一气体则有沉淀。则通入
的气体可能是
A. CO2 B. NH3 C. NO D.H2S
12、25℃时,向v ml pH = a的盐酸中滴加pH = b的氢氧化钠溶液10v ml时,溶液中恰
好有CCl- = CNa+,此时(a+b)的值为
A. 13 B.14 C.15 D.无法确定
![]() 13、图中的曲线是表示其它条件一定时,2NO + O2
2NO2
13、图中的曲线是表示其它条件一定时,2NO + O2
2NO2
放热,反应中NO的转化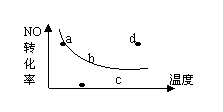 率与温度的关系曲线,图中标有
率与温度的关系曲线,图中标有
a、b、c、d四点,其中表示未达到平衡状态,且V正 >
V逆的点是
A. a点 B. b点 C. c点 D. d点
14、相同体积的一元酸HA的溶液和一元碱BOH的溶液相混合后pH=7,下列叙述中正确的是
A. 0.01mol·L-1的BOH溶液的pH一定等于12
B. HA和BOH溶液物质的量浓度一定是前者小于后者
C. 生成的盐BA一定不水解
D.一定有如下关系:c(A-1)=c(B+)
15、为了从新制的氯水中制得高浓度的次氯酸,可向氯水中加入的试剂是
A.Na2CO3 B. H2SO4 C. CaCO3 D. Ca(OH)2
16、下列各组离子中,能在水溶液中大量共存且溶液显酸性的是
A. Al3+、HCO3-、Na+ B. Al3+、Mg2+、SO42-
C.AlO2-、HCO3-、Na+ D. Al3+、AlO2-、Cl-
17、下列离子方程式书写正确的是
A. FeCl2溶液中通入Cl2:Fe2++Cl2==Fe3++2Cl-
B. 澄清石灰与少量小苏打溶液混合:Ca2++OH-+HCO3-==CaCO3↓+H2O
C. FeS固体放入稀硝酸溶液中:FeS+2H+==Fe3++H2S↑
D. AlCl3溶液中加入过量氨水:Al3++3NH3·H2O==Al(OH)3↓+3NH4+
18、红磷和硫磺在两个纯氧集气瓶中燃烧(如图所示),当火焰熄灭时,打开K1和K2观察
到的现象是
A.水迅速进入甲瓶和乙瓶
B.水都不进入甲、乙两瓶
C.水只能进入甲瓶而不能进入乙瓶
D.水只能进入乙瓶而不进入甲瓶

高三化学月考答题纸
一、单项选择题:(32分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、不定项选择题:(40分)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共20分)
19、(12分)根据右图回答问题:
⑴右图装置中,在反应前用手掌紧贴烧瓶外壁检查
装置的气密性,如观察不到明显的现象,还可以用什么
简单的方法证明该装置的不漏气
⑵写出浓硫酸和木炭粉在加热条件下发生反应的化
学方程式: 。
⑶如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。实验时,C中应观察到的现象是 。
D中加入的试剂是 ,作用是 。
20、(8分)草酸晶体的组成可表示为H2C2O4·xH2O为测定x值,进行下述实验:①称取w g 草酸晶体配成100.00 ml水溶液;②取25.00 ml所配的草酸溶液置于锥形瓶中,加适量稀H2SO4后,用浓度为a mol/L的KMnO4溶液滴定,所发生的反应为
2 KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 10CO2 + 2MnSO4 + 8H2O,反应生成的MnSO4在水溶液中基本无色。试回答下列问题:
(1)实验滴定时,KMnO4溶液应装在 式滴定管中。
(2)在滴定过程中,达到滴定终点的标志是 。
(3)若滴定过程中,用少量蒸馏水洗锥形瓶内壁,再继续滴定,则所测得的x值
(填“偏大”、“偏小”或“无影响”下同);记录测定结果时,滴定前平视刻度线,滴定到达终点时,又俯视刻度线,将导致滴定结果 ;若在滴定终点后,因操作错误多加1滴KMnO4溶液则应采取何措施 。若滴定过程中,液体飞溅出来,则应采取何措施 。
(4)若滴定过程中,共用去a mol/L KMnO4溶液 v ml,由此可计算出草酸晶体结晶水的x值为 。
四、(本题共4小题, 共42分)
21、(10分)(1)有一种溶液除H+、OH -外,还有Na+、SO42-和Cl -,测得三种离子的浓度分别是0.01 mol/L、0.0035 mol/L和0.004 mol/L,该溶液的pH
(2)在焊接铁制金属时,常要用NH4Cl浓溶液除去金属表面的铁锈(主要成分是Fe2O3),试用离子方程式表示这一反应 ,
。
(3)液氨类似于水的电离,试写出液氨的电离方程式: ;在液氨中加入NH4Cl,则平衡将向 移动,液氨的离子积常数将 (填增大、减小或不变)
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来的体积的m倍和n倍,稀释后两溶液的pH仍相同,则m n(填大于、小于、等于,下同);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m n。
22、(8分)KClO3和浓盐酸在一定温度条件下反应会生成黄绿色的易爆物二氧化氯,其变化可表示为:
![]()
![]()
![]()
![]()
![]()
![]()
![]() KClO3+ HCl(浓)—— KCl+ ClO2↑+ Cl2↑+
KClO3+ HCl(浓)—— KCl+ ClO2↑+ Cl2↑+
⑴请完成该化学方程式并配平(未知物化学式和系数填入框内)
⑵浓盐酸在反应中显示出来的性质是 (填写序号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
⑶产生0.1molCl2,则转移的电子的物质的量为 mol
|
23、(15分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。接通电源后,向乙中滴入酚酞试液,在F极附近显红色。
试回答下列问题:
⑴A是外加电源的 极,B是 极。
⑵写出甲装置电极反应式和电解反应的总反应方程式。
⑶如果收集乙装置中产生的气体,则阴极和阳极产生的气体在相同状况下体积比为: ,若收集甲和乙装置的气体,则相同状况下总气体体积比为
⑷欲用丙装置给铜镀银,铜件是 (填G或H)极,电镀液是 溶液
⑸装置丁是什么装置,可以观察到什么现象,可以说明什么问题?
24、(9分)下图中每一个方格表示一种反应物或生成物(反应中的水以及部分反应中生成的常温下呈气态的物质均已略去)。已知D是一种盐,焰色反应是浅紫色。
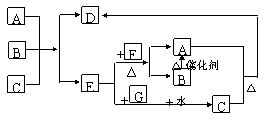
⑴A是 ,B是 ,G是 (用化学式表示)
|
![]() ⑶E+F
A+B的离子反应方程式
⑶E+F
A+B的离子反应方程式
⑷A、B、C三种物质反应的物质的量之比为
五、计算(本题共2题,共16分)
25、⑴将mg铁粉和ng硫粉均匀混合,在密闭容器中加热到红热,冷却后加入多少毫升bmol·L-1的盐酸就不再产生气体?若把已放出的气体收集起来,在标准状况下的体积共是多少升?
⑵若把0.1mol铁粉和1.6g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24L,简述其原因。
26、已知NaOH和Ba(OH)2混合溶液的pH=14,现取100ml该混合溶液,缓缓通入CO2,当通入的CO2气体体积为0.56 升时,生成的沉淀已达最多,(设CO2被完全吸收,气体的体积均为标况下沉淀,溶液的体积变化忽略不计);则:
①原混合溶液中NaOH、Ba(OH)2的物质的量浓度为多少?
②当通入的CO2总体积为2.24升时,溶液中各离子(除H+ 和OH -)的物质的量的浓度为多少?
上学期高二化学月考试题答案
一、二选择题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | B | B | B | B | D | A | AD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | BD | A | C | D | C | B | BD | C |
三.
|
(2)C+H2SO4(浓)===CO2+2SO2↑+2H2O
(3)无水硫酸铜,验证水的存在;品红溶液,验证SO2的存在;足量酸性KMnO4溶液,除尽SO2气体,颜色变淡,但未褪去;加入Ca(OH)2,验证CO2的存在.
20.(1)酸;(2)锥形瓶中溶液由无色变为浅紫色;(3)无影响,偏大;用已知浓度的草酸溶液滴定至红色褪去;重新实验;(4)50W/9av-5
![]() 21.(1)3 (2)6NH4++Fe2O3+3H2O=6NH3·H2O=6NH3+2Fe2+,
21.(1)3 (2)6NH4++Fe2O3+3H2O=6NH3·H2O=6NH3+2Fe2+,
(3)2NH3 NH2-+NH4+ ,左, 不变.
(4)大于,等于.
22. 2,4,2,2,1,2H2O,(2)② 0.2 2.6
23.(1)正,负
![]() (2)阴:2Cu2++4e-=2Cu 阳:4OH- -4e-=O2↑+2H2O
(2)阴:2Cu2++4e-=2Cu 阳:4OH- -4e-=O2↑+2H2O
2CuSO4+2H2O 2Cu+O2↑+2H2SO4
(3) 1 :1,1 :4,(4)H,AgNO3
(5)电泳装置,可以观察到Y极红褐色加深,说明Fe(OH)3胶体带正电.
24.(1)A.KCl B.KClO3 G..SO2
(2)Cl2+SO2+2H2O=2HCl+H2SO4,
(3)3Cl2+6KOH=KClO3+5KCl
(4)因 KClO3+5KCl+3H2SO4=3K2SO4+3Cl2↑+3H20,
为 5 :1 :3
25.(1)需盐酸的物质的量只与铁的物质的量有关,与硫的量无关.
v(HCl)=2000m/(56·b) ml
产生的气体的体积也只与铁的物质的量有关.
V=22.4m/56 L
(2)因为混合加热反应时,有一部分硫被氧化生成SO2,同时有部分铁也可能性被氧化.结果反应后的混合物与硫酸反应时产生的气体就少了.
26.(1)n(CO2)1=0.025mol
n(Ba2+)=0.025mol
c[Ba(OH)2]=0.25mol/L
pH=14,c(OH-)=1mol/L ,
c(NaOH)=0.5mol/L
(2)n(CO2)=0.1mol/L与OH-反应时生成HCO3-
因不溶于过量CO2,所以有:
c(Na+)=0.5mol/L , c(HCO3-)=0.5mol/L .