高三化学-铁
一、选择题(本题共20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1. 一般情况下,高碳钢的含碳量范围是 ( )
A. 0.03─2% B. 0.3─0.6% C. 0.6─2% D. 2─4.3%
2. 不能由单质直接化合而得到的化合物是 ( )
A. FeCl2 B. Al2S3 C. CuCl2 D. Mg3N2
3. 向500 mL 含有FeCl3和AlCl3的溶液中通入一定量的H2S气体,恰好完全反应。 过滤,所得滤液的质量比原溶液的质量增加1 g,则原FeCl3溶液的物质的量浓度是 ( )
A. 0.1 mol / L B. 0.2 mol / L C. 1 mol / L D. 2 mol / L
4. 把铁片投入下列某溶液中,铁片溶解且其质量减轻,也没有气体产生。该溶液是
( )
A. Al2(SO4)3 B. FeSO4 C. Fe2(SO4)3 D. CuSO4
5. 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:(MCE01)
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO2→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
A. Fe3+ B. MnO4- C. Cl2 D. HNO2
6. 常温下既可与稀硝酸反应,又可与氨水反应的物质是 ( )
A. (NH4)2CO3 B. Al(OH)3 C. FeSO4 D. CuCl2
7. 下列试剂中能用来分离Fe3+与Al3+的是 ( )
A. 氨水 B. NaOH C. (NH4)2CO3 D. HCl
8. 下列说法正确的是 ( )
A. 氧化性:Cl2>I2>Fe3+ B. 热稳定性:NaOH>Al(OH)3>AgOH
C. 熔点:生铁>纯铁>铝 D. 还原性: Br->I->S2-
9. 在铁粉中加入稀硝酸,当反应完全后,尚残留少量铁粉, 则溶液中含量较大的阳离子是 ( )
A. Fe2+ B. Fe3+ C. H+和Fe2+ D. Fe2+和Fe3+
10.把生铁冶炼成碳素钢要解决的主要问题是 ( )
A.除去生铁中的各种杂质,把生铁提纯(MCE01春)
B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质
C.用还原剂把铁的氧化物还原成铁
D.加入合金元素改善生铁性能
11. 下列各组物质相互反应后,再滴入KSCN溶液能显红色的是 ( )
A. 氯水和氯化亚铁 B. 铁屑和氯化铜溶液
C. 铁和稀盐酸 D. 铁屑和稀硝酸(反应后铁屑尚有剩余)
12. 要使Fe(OH)2氧化成Fe(OH)3而又不引入杂质,应向其悬浊液中加入 ( )
A. 新制氯水 B. 浓硝酸 C. 过氧化氢 D. 过氧化钠
13. 在强酸性溶液中有大量的Ba2+、Fe2+,则溶液中还可能含有的较多阴离子是( )
A. ![]() B.
B.
![]() C.
S2-
D. Cl-
C.
S2-
D. Cl-
14. 下列反应由于氧化而引起溶液颜色变深的是 ( )
A. 向FeCl3溶液中通入H2S气体 B. 向Fe(NO3)2溶液中加入硝酸少许
C. 向Fe(NO3)3溶液中加入硫氰化钾溶液 D. 向Na2SO3溶液中加入溴水
15. 将56 g铁粉和16 g硫粉隔绝空气加热,使其充分反应并冷却后,再加入适量盐酸,最后可得气体体积为(标准状况) ( )
A. 5.6 L B. 11.2 L C. 22.4 L D. 44.8 L
16. 在钢铁腐蚀过程中,下列五种变化可能发生的是 ( )
①Fe2+转变为Fe3+ ②氧气被还原 ③产生氢气 ④Fe转变为Fe2+ ⑤Fe(OH)3失去水形成Fe2O3·H2O
A. ③和④ B. ②和④ C. ①②③④ D. 全部
17. 下列反应中没有发生Fe3+ →Fe2+的变化的有 ( )
A. 将铁屑投入显黄色的工业盐酸中 B. 铁屑和FeCl3溶液反应
C. 滴溴水于FeSO4溶液中 D. 铜片放入浓FeCl3溶液中
18. 现有2 mol / L的盐酸和硫酸溶液各100 mL,分别加入等质量的铁粉,反应结束后,测得生成的气体的质量比为2∶3,则加入铁粉的质量可能是 ( )
A. 2.8 g B. 5.6 g C. 8.4 g D. 16.8 g
19. 将Na2O2投入FeCl3溶液中,可观察到的现象是 ( )
A. 生成白色沉淀 B. 生成黄色沉淀 C. 有气泡产生 D. 无变化
20. 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01 mol的溶液中加入0.01mol铁粉,经充分搅拌后,发生变化有 ( )
A. 铁溶解,但没有其它任何金属析出
B. 铁溶解,析出0.01 mol银,并且溶液中不再含有Fe3+,而含有0.02 mol Fe2+
C. 铁溶解,析出0.01 mol银和0.005 mol铜
D. 铁溶解,析出0.01 mol银,溶液中含有0.005 molFe3+和0.015 mol Fe2+
二、填空题(本题包括7小题,共30分)
21. (2分)为提高生活用水的卫生标准,自来水厂常同时使用氯气和绿矾(FeSO4·7H2O)进行消毒,净化以改善水质,其原理是_____________________________________________
____________________________________________________________________________。
22. (2分)150 mL浓度为0.2 mol / L的FeSO4溶液(含有少量稀H2SO4)跟50 mL浓度为0.1 mol / L的K2Cr2O7溶液混合,恰好溶液中Fe2+全部转化为Fe3+,K2Cr2O7被还原为铬的某低价阳离子。请写出二者反应的离子方程式:________________________________________。
23. (6分)现有a、b、c、d四种黑色粉末,当分别加入盐酸并加热时, 观察到如下现象,据此现象确定该物质(写出分子式)
| 物质 | 观 察 到 的 现 象 | 分子式 |
| a | 溶解并放出气体,该气体通入酸性硝酸银溶液产生白色沉淀 | |
| b | 溶解并放出气体,该气体能使润湿的醋酸铅试纸变黑而溶液则为淡绿色 | |
| c | 溶解后加入足量氨水,先产生蓝色沉淀后再溶解 | |
| d | 溶解后加入足量氨水,产生白色沉淀,且沉淀迅速变成灰绿色,最后变成红褐色 |
能说明物质b的上述反应现象的化学方程式是
_________________________________________________________________;
_________________________________________________________________。
24. (2分)某溶液中含有一定量FeCl3和FeCl2。今向此溶液中加入足量铁粉, 充分搅拌,待反应不再进行后,将溶液过滤,发现滤渣的质量与原来加入的铁粉质量相等。则原溶液中,Fe3+、Cu2+和Cl-的物质的量之比为____________。
25. (5分)绿矾晶体放置时间长了往往变棕黄色,这是因为_________________________
____________________,检验绿矾是否被氧化,应将绿矾溶于水,加入________________,
根据_________________________可知已被氧化。如果要使部分氧化的绿矾[其中含少量的Fe(OH)3]恢复原状,应将其溶解于水,加入__________________________________,然后_______________________________________________。
26. (6分)电子工业常用30%FeCl3溶液腐蚀敷有铜箔的塑料板,制成印刷电路板。为了从使用过的废液中回收铜,并重新制得纯净的FeCl3溶液,拟采用下列实验步骤。 请在各步骤的括号内填写适当的试剂或生成物的分子式,使实验能达到予期的结果。
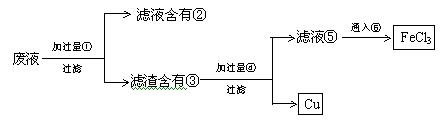
①______,②________,③__________,④________,⑤_________,⑥_________。
27. (7分)将等质量混合的铜、锌、铁三种金属组成的混合物W g 加入到FeCl3和盐酸组成的混合液中,充分反应后:
(1) 若无固体剩余,则溶液中一定有的金属离子是_____________________, 可能有的金属离子是________________。
(2) 若剩余固体![]() g,则溶液中金属离子一定有_____________________, 一定没有________________。
g,则溶液中金属离子一定有_____________________, 一定没有________________。
三、计算题(10分)
28.(10分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
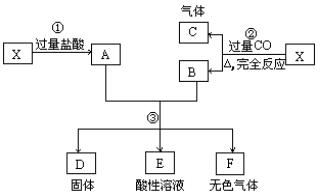
(1)写出①、②和③步所有反应的化学方程式;(MCE01春)
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比。
答 案
1.C 2.A 3.D 4.C 5.B 6.C 7.B 8.B 9.A 10.B 11.A 12.C 13.D 14.B 15.C 16.D 17.C 18.C 19.C 20.B
21. (2分)Cl2与水反应生成HClO,HClO能杀死水中细菌起消毒作用;Cl2能将Fe2+ 氧化成Fe3+,Fe3+水解生成的Fe(OH)3胶体具有很强的吸附能力, 可吸附水中悬浮的杂质形成沉淀,使水净化。
22. (2分)6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O
23. (每空1分)MnO2; FeS; CuO; FeO; FeS+2HCl=FeCl2+H2S↑;(CH3COO)2Pb+H2S=PbS↓+2CH3COOH
24. (2分)2∶7∶20
25. (每空1分)绿矾被部分氧化为硫酸铁; KSCN溶液; 变血红色; Fe和H2SO4; 过滤后重新结晶
26. (每空1分)Fe; FeCl2; Fe、Cu; HCl; FeCl2; Cl2
27. (1)Cu2+、Fe2+、Zn2+(2分); Fe3+(1分) (2)Fe2+、Zn2+( 2分); Cu2+、Fe3+(2分)
28.1.(1)CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O
(2)CuO+CO=Cu+CO2, FeO+CO=Fe+CO2
(3)Fe+CuCl2=Cu↓+FeCl2,Fe+2HCl=FeCl2+H2↑
2.![]() , 80 g/mol×0.25 mol=20 g(CuO)
, 80 g/mol×0.25 mol=20 g(CuO)
![]() , 0.25 mol+0.25 mol=0.5 mol(Fe)
, 0.25 mol+0.25 mol=0.5 mol(Fe)
0.5 mol×72 g/mol=36 g(FeO)
则X的质量为56 g,FeO与CuO的质量比为9:5