高三化学推断题
1.A和B是同周期相邻元素,B和C是同族相邻元素,A、B、C的价电子数之和为19,则A、B、C三种元素依次是 ( B )
A. S、O、F B. F、O、S C. S、Cl、O D. O、S、Cl
2.甲、乙、丙为短周期的三种元素。甲、乙依次位于周期表中同周期的相邻主族,乙元素的族序数为丙元素的两倍。甲、乙、丙原子的价电子数之和为11,电子层数之和为7。则三种元素的名称是:甲_______,乙_______,丙_______。
2. 氮 碳 镁
3.有A、B、C三种元素,已知A、B同周期,B、C同主族,三种元素质子数之和为39,最外层电子数之和为17,则三种元素的元素符号分别为 。
3. P、S、O或Cl、P、N或F、Cl、Al
4.X、Y、Z三种元素核电荷数之和为26,X、Y处于同一周期,Z在X、Y的下一周期,红热的铜丝能在Z元素的单质里燃烧,生成棕色烟;Y元素原子的最外层电子数比次外层电子数少1。则X为 ,Y为 ,Z为 。
4. C;Li;Cl
5.有X、Y、Z三种元素,其原子序数依次增大,且位于同一周期,价电子数之和为10。它们的最高氧化物的水化物之间,任意两种都能反应生成盐和水;M元素与上述三种元素位于相邻的周期,而M原子的L电子层上有4个电子。试写出这些元素的元素符号:X_______,Y_______,Z________,M________。
5. Na;Al;S;C
6.今有A、B、C、D四种短周期元素,它们的核电荷数依次增大。A与C,B与D分别是同族元素。B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素单质易溶于CS2溶剂中,则四种元素是:A:_______,B:_______,C:_______,D:________。
6. H;O;Na;S
7.X、Y、Z三种主族元素分别位于相邻的三个不同周期里,且原子序数的大小顺序是Z>X>Y。元素Y的原子次外层的电子数为2,其最高氧化物的水化物是强酸。X、Y的族序数之和等于Z的族序数,X的氧化物难溶于水,则X与Y形成的化合物的化学式为(用元素符号表示):____________;Z的元素符号为________。
7. Mg3N2;Br
8.A、B、C三种元素在周期表中处于相邻位置,A、B同周期,B、C同主族,三元素原子最外层电子数之和为17,质子数之和为31。求此三元素。
8. N;O;S
9.X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物的水化物是一种强酸。由此推出X、Y、Z分别为 ,有关反应为 。
9. Mg;N;Br;Mg+Br2=MgBr2;Br2+H2O=HBr+HBrO;Mg+2HBr=MgBr2+H2
10.某元素X的最高氧化物与水化合成三元酸,该酸分子中各元素原子个数比为X ∶H∶O=0.5∶1.5∶2,其中氢元素占分子总质量的3.06%,X原子中的中子数比质子数多1,则X为_____,位于第______周期,第_______族,三元酸的分子式为______________。
10. Si;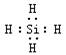
11.甲、乙、丙3 种元素,甲元素的+2价阳离子具有氩原子的电子层结构;乙元素比甲元素的原子少一个电子层,其离子带一个单位正电荷。它们均可跟17号元素丙化合。则甲丙组成的化合物为___________;乙丙组成的化合物为___________;两种化合物做焰色反应时,其焰色分别为______色和_______色。
11. CaCl2;NaCl;砖红;黄色
12.有A、B、C、D、E五种元素, 它们的原子序数由A至E逐渐增大。D 的氢化物的分子式为H2D;D的最高氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。 E原子的M电子层上共有6个电子。常温常压下,B单质是气体,已知0.1 mol的B 单质与H2完全反应需2.408×1023 个氢原子。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试回答下列各问题:
(1) A—E的元素符号为:______、______、______、______、______。
(2) C位于元素周期表中第_____周期、第______族,其阳离子的结构示意图为______。
(3) D原子的电子式为____________;E离子的符号为________。
(4) A元素与其余4种元素形成化合物的化学式为(仅限于由两种元素组成)_________、________、_________、_________。
(5) C单质和B单质在加热条件下生成A2B2反应的化学方程式_______________________
____________________,反应中________为氧化剂;________为还原剂。
(6) 1.15 g的C单质溶于50 mL水中,所得溶液中溶质的质量分数为_____________。
12. (1)C O Na S Cl (2)第三周期 ⅠA ![]() (3)
(3)![]() Fe2+ (4)CO CO2 CS2 CCl4 (5)2Na+O2=Na2O2 O2 Na (6)3.91%
Fe2+ (4)CO CO2 CS2 CCl4 (5)2Na+O2=Na2O2 O2 Na (6)3.91%
13.A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差1。A 元素的单质的化学性质活泼,A元素的原子在本周期中原子半径最大。B元素的氧化物2.0 g恰好跟100 mL 0.40 mol/L 硫酸完全反应。B元素单质跟D元素单质反应生成化合物BD2。 根据以上事实填写下列空白:
A的原子结构示意图___________;C离子的结构示意图___________;BD2的电子式__________。若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液呈碱性。 这一反应的化学方程式为______________________________________。B的单质能在原子序数为7的元素的单质中燃烧,这一反应的化学方程式为_________________________________。
13. ![]() ;
;![]() ;
;![]() ; Al(OH)3+NaOH=NaAlO2+2H2O;3Mg+N2=Mg3N2
; Al(OH)3+NaOH=NaAlO2+2H2O;3Mg+N2=Mg3N2
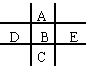
14.右图为周期表的一小部分,A、B、C、D、E的位置关系如图所示。其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
|
|
(1) A的质量数是______,是_______元素,位于第______周期,第_______族。
(2) B、C、E最高氧化物对应水化物是__________、__________、__________, 气态氢化物是_______、_______、_______,它们稳定性顺序是_______、_______、_______。
14. (1)16;氧;二;ⅥA (2) H2SO4;H2SeO4;HClO4; H2S;H2Se;HCl; HCl;H2S;H2Se
15.有A、B、C、D四种元素。A、B两元素的原子各有两个电子层,C、D 两元素的原子各有3个电子层,B和D两元素原子的最外层电子数相等 ;A和B元素可形成AB2 型化合物,AB2通常是无色、无气味的气体;B和D元素也可形成DB2型化合物,DB2是无色、 有剌激性气味的气体。AB2和DB2的晶体均为分子晶体;C的单质在B单质中燃烧时发生黄色火焰,产物为淡黄色固体。回答下列问题:
(1) A、B、C、D四元素的名称: A__________ 、 B___________ 、 C__________ 、
D__________。
(2) 用电子式表示AD2化合物的组成:_____________________。
(3) 四种元素的单质及化合物中,属于原子晶体的是(填名称)___________, 属于离子晶体的是__________、____________、_____________。
(4) 在一容器中充入x L AB2的气体,加入C2B2(不足量)后,经过一段时间容器内气体的体积缩小至y L,则剩余AB2气体的体积为(在同温同压下计量)_________。
15. (1)C;O;Na;S (2) ![]() (3)金刚石;Na2S;Na2O;Na2O2 (4) (2y-x) L
(3)金刚石;Na2S;Na2O;Na2O2 (4) (2y-x) L
16.A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1) A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2) 化合物C2A的电子式是______________,C2A 与稀硫酸反应的化学方程式是:
__________________________________________,C2A 与硫酸铜溶液反应的离子反应方程式是:______________________________________。
(3) A元素的气态氢化物通入硫酸铜溶液中反应的离子反应方程式是:
_____________________________________________________________________。
(4) 化合物BA2的电子式是:______________,结构式是:_______________。
16. (1)硫; 碳; 钠 (2)![]() ; Na2S+H2SO4=Na2SO4+H2S↑; Cu2+ +S2- = CuS↓ (3)Cu2++H2S = CuS↓+2H+ (4)
; Na2S+H2SO4=Na2SO4+H2S↑; Cu2+ +S2- = CuS↓ (3)Cu2++H2S = CuS↓+2H+ (4)![]() ; S=C=S
; S=C=S