![]()
|
|
学科:化学 |
| 教学内容:高三化学学科综合能力训练(一) |
【同步达纲练习】
可能需要的数据:
相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 Mg∶24 S∶32 Fe∶56 C u∶64 Co∶59 Ba∶137 Ca∶40 Zn∶65 Al∶27 Cl∶35.5 Ag∶108
一、选择题(只有一个选项符合题意)
1.下列物质按“赤、橙、黄、绿、蓝、紫”的颜色顺序编排的是:
①溴水 ②CuSO4 ③KMnO4 ④CuO ⑤AgI ⑥FeSO4·7H2O ⑦CuSO4·5H2O ⑧Fe2O3 ⑨Ag2S( )
A.①②③④⑤⑥ B.⑧①⑤⑥⑦③
C.③④⑤⑥⑧② D.⑧⑨⑤⑥②③
2.一种比黄金贵百倍的188O2气体,不久前在兰州近代物理研究所制备成功.1mol这种气体中所含中子的物质的量为( )
A.36mol B.20mol C.16mol D.10mol
3.下列变化属于物理变化的是( )
A.熔融态的氯化钠导电;
B.用加热的方法分离氯化钠固体和氯化铵晶体;
C.在氢氧化铁胶体中加入硫酸镁溶液析出红褐色沉淀;
D.将过氧化钠固体溶于水中.
4.下列洗涤不洁净的玻璃仪器的方法中属正确的是( )
A.做完制酚醛树脂的试管用水洗涤;
B.做完高锰酸钾制氧气后的试管用稀HCl洗涤;
C.做完碘升华后的小烧杯用酒精洗涤;
D.做完银镜反应后的试管用稀H2SO4洗涤.
二、选择题(有一个或两个选项符合题意)
6.已知钍原子(23290Th)可发生放射性变化:23290Th![]() 22888X+42He,其中X是生成的一种新元素,对X的判断正确的是( )
22888X+42He,其中X是生成的一种新元素,对X的判断正确的是( )
A.X位于第六周期;
B.X的单质能与冷水剧烈反应;
C.X的最高正价为+2价;
D.X的氢氧化物具有两性.
7.下列反应在加入少量物质后,反应速度将加快,但该反应不属于催化反应的是( )
A.在苯和液溴的混合物中加入少量铁屑;
B.在锌粒和稀硫酸的混合物中加入少量硫酸铜;
C.在镁粉和稀醋酸的混合物中加入少量醋酸钠;
D.在过氧化氢溶液中加入少量二氧化锰.
8.等量的苛性钠溶液分别用PH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则两者关系正确的是( )
A.Va>10Vb; B.Vb=10Va;
C.Vb<10Va; D.Vb>10Va.
9.下列离子方程式正确的是( )
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.碳酸钠与醋酸溶液反应: CO32-+CH3COOH=CO2↑+H2O
C.将1~2mL氯化铁饱和溶液加入到20 mL沸水中:Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
D.氢氧化铁与氢碘酸中和: Fe(OH)3+3H+=Fe3++3H2O
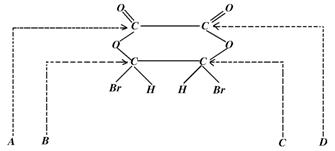
10.下图中A、B、C、D标出了一种环酯分子中的化学键,当其水解时断裂的化学键是( )
11.拉曼光谱表明溶液中不存在AlO2-离子,实际存在[Al(OH)4]-离子.0.2 mol /L Na[Al(OH)4]溶液200mL与0.2mol/L H2SO4溶液250mL混合,完全反应后,溶液中Al3+与SO2-4离子的物质的量之比约为( )
A.2∶5; B.1∶2; C.4∶5; D.2∶3.
12.在一定条件下,测得2CO2![]() 2CO+O2平衡体系的平均相对分子质量为M 。在此条件下,CO2的分解率是( )
2CO+O2平衡体系的平均相对分子质量为M 。在此条件下,CO2的分解率是( )
A.![]() B.
B. ![]()
C. ![]() D.
D. ![]()
13.在标准状况下,由甲烷、甲醛和乙烷组成的混合气体11.2L完全燃烧后,生成相同状况下的CO2气体15.68L.则混合气体中乙烷的体积分数为( )
A.20%; B.40%; C.60%; D.80%.
14.下列叙述正确的是( )
A.明矾能净水,常用于软化硬水;
B.红磷用于制安全火柴,涂在火柴头上;
C.铝密度小,硬度大,故用于制造飞机;
D.醋酸纤维不易着火,用于制电影胶片片基.
15.有机物L的分子式为C3H6O2,水解后得到一元酸M和一无醇N.已知M、N的分子量相等,则下列叙述中不正确的有( )
A.M、N互为同分异构体;
B.L、M都具有还原性;
C.M与软脂酸互为同系物;
D.N能与水以任意比互溶.
16.下列离子方程式正确的是( )
A.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3![]() +3NH+4;
+3NH+4;
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO2-3;
2C6H5OH+CO2-3;
C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-;
D.Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO-3+4OH-=Mg(OH)2 +2CO2-3+2H2O.
17.下列反应中,有黄色物质生成的是( )
A.鸡蛋白溶液中加几滴浓硝酸混合加热;
B.H3PO4溶液中加入AgNO3溶液;
C.苯酚溶液中加几滴FeCl3溶液;
D.H2S气体通过灼热的玻璃管.
18.下列实验中都要使用催化剂,其中催化剂使用错误的是( )
A.用乙醇和过量的3mol/L硫酸的混合液加热制取乙烯;
B.用氯酸钾和少量高锰酸钾加热制取氧气;
C.将苯酚、40%甲醛溶液和少量浓盐酸混合水浴加热,制取酚醛树酚;
D.将少量蔗糖溶液和浓硫酸混合煮沸使蔗糖水解.
19.心脏起搏器中使用的新型Li-I2电池的使用寿命已超过10年,其反应简化为:2Li+I2 =2LiI,下列说法中不正确的是( )
A.负极反应:Li-e=Li+
B.该电池以LiI水溶液为电解质
C.该电池以有机碘化物为电解质
D.Li-I2电池是一种高能、长寿的固体电池
20.下列说法正确的是(N0表示阿伏加德罗常数的值)( )
A.1L 0.1mol/L的Al2(SO4)3溶液中含有0.1N0个SO2-4;
B.标准状况下,22.4L H2和O2混合气体与22.4L甲烷和乙烷混合气体,都含有N0个分子;
C.SO2与H2S反应成3molS,发生转移的电子数为4N0;
D.1mol甲烷中含有的电子数为16N0.
三、选择题(只有一个选项符合题意)
21.将10mL 0.1mol/L的H2SO4与10mL 0.1mol/L的BaCl2混合,从中取出1ml加水稀释至1L,滴入甲基橙试液,溶液呈现的颜色是( )
A.红; B.黄; C.橙; D.蓝.
22.电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况).则a和b分别为( )
A.a=0.25,b=2.24; B.a=0.05,b=2.24;
C.a=0.25,b=4.48; D.a=0.3,b=3.36.
23.有主族元素形成的三种离子:Xn+、Ym-、Zm+,已知m>n,Xn+ 与Zm+多1个电子层,Z与Y同周期,三种原子的M层电子数均为偶数,则Y元素为 ( )
A.硅 B.氧 C.硫 D.碳
24.室温下,测得甲醛、乙醛和丙酮组成的液态混合物中氢元素的质量的百分含量为9.8%, 该混合物的平均分子量为( )
A.50; B.51; C.49; D.44.
25.在1升密闭容器中,把1molA和1molB混合发生如下反应:3A(气)+B(气)![]() xC(气 )+2D(气),当反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4mol/L,下列叙述中不正确的是( )
xC(气 )+2D(气),当反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4mol/L,下列叙述中不正确的是( )
A.X的值为2; B.A的转化率为40%;
C.A的平衡浓度为0.4mol/L; D.B的平衡浓度为0.8mol/L.
26.25℃时,硫酸铜的溶解度为Sg。同温下,把Sg无水硫酸铜粉末加入到(100+S)g饱和硫酸铜溶液中,得到一定量的蓝色晶体。若将此蓝色晶体溶解成饱和溶液,应加水的质量是( )
A.(100+S)g B.(100-![]() )g C.100g D. (100-
)g C.100g D. (100-![]() )g
)g
四、非选题
27.晶体A的焰色呈紫色,它可以发生下图所示的转化,各反应除图中所示物质以及反应条件外,其余的反应物、生成物及反应条件均已略去。其中B是黑色粉末,C、D、E、F在常温下都是气体。
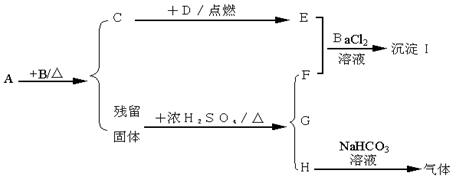
(1)判断A~I是什么物质?
(2)完成H与NaHCO3溶液反应的化学方程式。
28.实验室用MnO2作催化剂加热分解KClO3制备O2,是在1820年由德国贝尔纳首次实现的.当时发现气态产物有异味,后来用实验证明其中含少量Cl2和O3等杂质,而O3比O2的氧化性更强,它跟还原剂反应时通常生成O2,碳酸钴(CoCO3)在加热时能跟O2发生反应,可表示为xCoCO3+![]() O2
O2![]() xCO2+CoxOy(褐色),现在利用图中装置测定固定CoxOy的组成.
xCO2+CoxOy(褐色),现在利用图中装置测定固定CoxOy的组成.
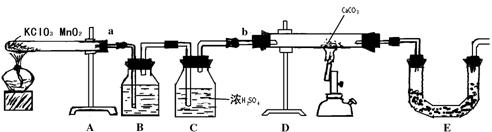
请回答:
(1)E装置的U型管内应填充的试剂是(填字母) ;
A.五氧化二磷; B.无水氧化钙;
C.无水硫酸铜; D.碱石灰.
(2)实验时,若将接口a与b直接相连,而不用B、C装置,会导致测定结果产生偏差,其原因是 .
(3)B装置内所盛试剂可以是(填字母) .
A.NaOH; B.饱和NaHCO3溶液;
C.饱和NaCl溶液; D.KI溶液.
(4)实验结束时,若先撤去A装置中的酒精灯,会引起 .
(5)CoCO3完全转化为褐色的CoxOy后,称得E管质量增加4.4g,D管内残留物质为8.3g,通过计算求CoxOy中的x∶y= .
29.在一个容积为5L的密闭容器中,充入NH3和O2,它们的摩尔比为1∶2,发生如下反应:4NH3+5O2![]() 4NO+6H2O(气)
4NO+6H2O(气)
(1)上述反应在一定条件下2min后达到平衡,NH3为2mol,NH3的转化率为20%,以NO的浓度变化表示该反应的平均速度为 ,O2的平衡浓度为 .
(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的体积不变,平衡 移动;如果总压强保持不变,平衡又 移动.
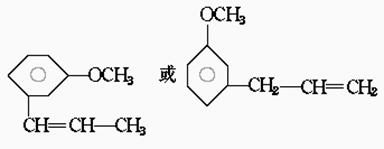
30.从月桂叶油中分离出两种异构体化合物Z和W;它们都具有C10H12O的化学式它们都不溶于水、稀酸及稀碱,对稀KMnO4和Br2/CCl4溶液都发生反应。经剧烈气化都生成茴香酸(m-CH3OC6H4COOH,m-间位),催化氢化可使Z和W转变成同一化合物(C10H14O)。已知:
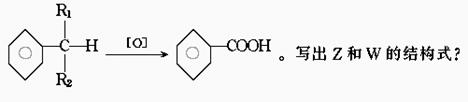
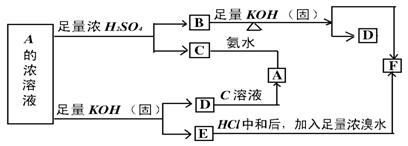
31.某物质A的水溶液在一定条件下发生如图所示的一系列反应,其中C、D为中学化学中的常见气体,请回答.
(1)A![]() F的化学式:
F的化学式:
A B C
D E F
32.写出下列叙述中有关物质的结构简式:
分子式为C3H7Br的卤代烃经消去反应后得到的有机物 ;能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是 ;含C、H、O三种元素的有机物,燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1∶2∶2,则此类有机物中最简单的一种是 .
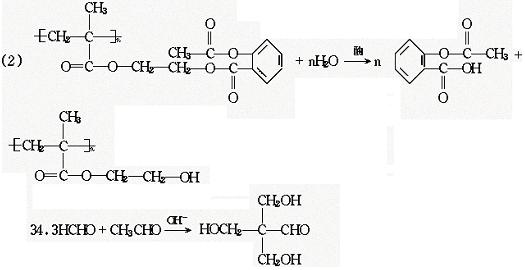
33.科学家把药物连接到高分子载体上,要制成缓释长效药剂,阿斯匹林是常用解热镇痛药物,其结构简式如A,把它连接在某聚合物上,形成缓释长效阿斯匹林,其中一种的结构简式为B:
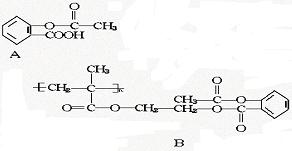
(1)缓释长效阿斯匹林中含有酯基的数目是 ;
(2)服药后,在人体内发生反应释放出阿斯匹林的化学方程式是 .
34.已知与—CHO相连的碳原子所结合的氢原子称为α—H,α—H有一定的活泼性,可发
生下列反应: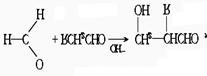 当甲醛足量,另一醛中的α—H 可继续发生上述反应,直至α—H消耗完.又知无α—H的醛可发生下列氧化—还原反应:— CHO+—CHO
当甲醛足量,另一醛中的α—H 可继续发生上述反应,直至α—H消耗完.又知无α—H的醛可发生下列氧化—还原反应:— CHO+—CHO
![]() —COO-+—CH2OH,若把两种没有α—H的醛混合,发生氧化—还原反应时,还原性强的醛使对方还原为醇,而自身被氧化为羧酸.甲醛在醛类中还原性最强.
—COO-+—CH2OH,若把两种没有α—H的醛混合,发生氧化—还原反应时,还原性强的醛使对方还原为醇,而自身被氧化为羧酸.甲醛在醛类中还原性最强.
请用中学教材中学过的醛制备季戊四醇: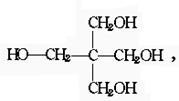 写出化学反应方程式:(有机物写结构简式) .
写出化学反应方程式:(有机物写结构简式) .
35.水在自然净化中,要把有机污染物自发地氧化转变为简单的无机物质。1L水中含的有机物转化为无机物所需的氧气的量称为生化需氧量(BOD),其单位用(g·L-1)表示。
某地区一条污水河,测定其中含0.001%的有机物(该有机物的化学式以C6H10O5表示),已知20℃时常压下,氧气在水中的溶解度为0.009 2g·L-1,鱼类在含氧量小于 0.004 g·L-1的水中不能生存。
(1)计算这条河中的BOD。
(2)判断此条河中的鱼能否生存。
36.在常温常压下,把a mol的NH3和O2的混合气充入密闭容器中,在催化剂存在下加热 ,使其充分反应,然后恢复到原来的温度和压强.
(1)写出容器内NH3被氧化和形成HNO3的化学方程式.
(2)若原混合气中O2的体积分数为x,最后在容器中生成的HNO3为ymol.
请填写下表.
| X的取值范围 | 用x表示的y值表示式 |
(3)在坐标图上画出y=f(x)的关系曲线.

参考答案
【同步达纲练习】
一、1.B 2.B 3.C 4.C
二、6.BC 7.B 8.D 9.C 10.AD 11.A 12.B 13.B 14.D 15.A 16.C 17.AD 18. AD 19.BD 20.BC
三、21.C 22.A 23.C 24.B 25.B 26.C
四、27.这是一道元素化合物综合推断题,考查了氧族、卤族的知识。由晶体A的焰色呈紫色,知为含K+的物质,它与黑色固体混合加热可生成气体,显然是KClO3![]() O2,以它为突破口,残留固体是KCl和MnO2,遇浓H2SO4/△产生Cl2。H是NaHSO4(遇NaHCO3溶液放出气体)。沉淀I中的S元素,显然是D提供的,故D为H2S。
O2,以它为突破口,残留固体是KCl和MnO2,遇浓H2SO4/△产生Cl2。H是NaHSO4(遇NaHCO3溶液放出气体)。沉淀I中的S元素,显然是D提供的,故D为H2S。
(1)依次为KClO3,MnO2,O2,H2S,SO2,Cl2,MnSO4,NaHSO4,BaSO4
(2)NaHSO4+NaHCO3=Na2SO4+CO2↑+H2O
28.(1)D
(2)A中产生的少量Cl2和水蒸气被碱石灰吸收,D装置管中还能生成部分Co的氧化物
(3)A、D
(4)装置B中液体倒吸至A中,导致试管破裂
(5)2∶3
29.(1)0.05mol/L·min;0.875 mol/L
(2)不;向正反应方向
30.解析:C10H12O经氧化后的产物是![]() 与氧化前相比,少2个碳,C10H12O可与KMnO4 、Br2/CCl4反应,说明除苯环外,含不饱和键,经催化氢化后(苯环不变)得C10H14O知只含一个双键。故为
与氧化前相比,少2个碳,C10H12O可与KMnO4 、Br2/CCl4反应,说明除苯环外,含不饱和键,经催化氢化后(苯环不变)得C10H14O知只含一个双键。故为
31.(1)A.(NH4)2SO3或NH4HSO4 B.(NH4)2SO4或NH4HSO4 C.SO2 D .NH3 E.K2SO3 F.K2SO4
32.CH2=CH—CH3;![]() ;HCOOH
;HCOOH
33.(1)3;
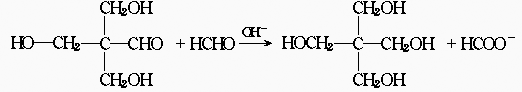
35.(1)该河水1L含有机物质量为
103g×0.001%=0.01g
设净化1L河水即氧化其中有机物所需氧气的质量为x,根据有机物C6H10O5的氧化方程式:
C6H10O5+6O2![]() 6CO2+5H2O
6CO2+5H2O
162g 32×6g
0.01g x
x=0.012g·L-1(BOD)
(2)因0.012g·L-1>0.009 g·L-1,则水中溶氧已被耗尽,鱼类不能生存。
36.解:(1)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
2NO+O2![]() 2NO2
2NO2
3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
(2)
| x | Xy |
| 0<x≤ | Y=0 |
|
| Y=(3x- |
|
| Y=(1-x)a |
(3)