高三化学练习卷
江苏省常熟中学化学组
本卷可能用到的相对原子质量:H:1,C:12,N:14,O:16,Al:27,S:32
请将选择题答案填入第I卷后面的表格中。
第I卷(选择题 共72分)
一、选择题(本题共8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1、以下说法正确的是
A、纳米材料是指一种称为“纳米”的新物质制成的材料
B、绿色食品是指不含任何化学物质的食品
C、四种分散系中的分散质微粒直径和纳米材料的粒子具有数量级的是乳浊液
D、光导纤维是以二氧化硅为主要原料制成的
2、氮化硅(Si3N4)是一种新型的耐高温耐磨材料,工业上有广泛用途。下列物质中能与氮化硅归纳为一类的是
A、氮化镁(Mg3N2) B、石英 C、四氟化硅 D、钨
3、下列叙述正确的是
A、最外层电子数较少的金属一定比最外层电子数较多的金属还原性强
B、同一主族的元素从上到下,金属性呈现周期性变化
C、非金属元素的氢化物不一定只有一种
![]() D、具有相同电子层结构的aA2+与bB—中,a=b
D、具有相同电子层结构的aA2+与bB—中,a=b
4、高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是:
A、BaS B、BaSO3 C、BaSO4 D、BaSO3和 BaSO4
5、等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5 : 6,则甲、乙两烧杯中的反应情况可能分别是
A、甲、乙中都是铝过量 B、甲中铝过量、乙中碱过量
C、甲中酸过量,乙中铝过量 D、甲中酸过量,乙中碱过量
6、在100mL等物质的量的HBr和H2SO3的溶液里通入0.01molCl2,有一半的Br—变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的物质的量浓度等于
A、0.0075mol/L B、0.008mol/L C、0.075mol/L D、0.08mol/L
7、将铁屑溶于过量盐酸后,加入KSCN溶液,再加入下列物质溶液,仍不出现红色的是
A、氯水 B、硝酸锌 C、过氧化氢 D、稀硫酸
8、可逆反应:3A(g) ![]() 3B(?)+C(?),△H>0,随着温度升高,气体的平均相对分子质量变小,则下列判断正确的是:
3B(?)+C(?),△H>0,随着温度升高,气体的平均相对分子质量变小,则下列判断正确的是:
A、B和C可能都是固体 B、B和C一定都是气体
C、若C为固体,则B一定是气体 D、B和C一定都是固体
二、选择题(本题共10小题,每小题4分,共40分。每小题有1个或两个选项符合题意)
9、有人曾建议用AG表示溶液的酸度,![]() 。下列表述正确的是
。下列表述正确的是
A、在25℃时,若溶液呈中性,则PH=7,AG=1
B、在25℃时,若溶液呈酸性,则PH<7,AG<0
C、在25℃时,0.1mol/L盐酸的PH=1,AG=12
D、在25℃时,溶液的PH与AG的换算公式为AG=2(7-PH)
10、关于氯化铁溶液和氢氧化铁胶体的下列叙述正确的是
A、它们的分散质微粒都能透过半透膜
B、加热蒸干,灼烧后,它们都有氧化铁生成
C、将棕黄色的饱和FeCl3溶液滴入沸水中,边滴边加热,可生成红褐色的Fe(OH) 3胶体。
D、除去Fe(OH) 3胶体中溶有的少量FeCl3,可用加入AgNO3溶液后再过滤的方法。
11、今有如下3个热化学方程式,下列叙述正确的是
H2(g)+1/2O2 (g)=H2O(g) △H=aKJ/mol
H2(g)+1/2O2 (g)=H2O(l) △H=bKJ/mol
2H2(g)+ O2 (g)=2H2O(l) △H=cKJ/mol
A、a、b、c均为正值 B、a>b= c /2
C、H2的燃烧热为aKJ/mol
D、已知 H2O(l)= H2O(g),△H=44KJ/mol 则a= c /2—44
![]() 12、某有机物分子中含有n个-CH2-,m个-CH-,a个-CH3,其余都为羟基(一个碳上不能同时连有二个羟基),则羟基的个数为
12、某有机物分子中含有n个-CH2-,m个-CH-,a个-CH3,其余都为羟基(一个碳上不能同时连有二个羟基),则羟基的个数为
A、m+2-a B、m+n-a C、m+a-n D、无法确定
13、1999年1月俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是
A、该元素位于第七周期 B、该元素为金属元素,性质与82Pb相似
C、该元素位于第ⅢA族 D、该同位素原子的中子数与核外电子数之差为70
14、下列各组离子在水溶液中能大量共存的是
A、Na+、Cu2+、Cl—、HS— B、H3O+、Fe2+、Cl—、NO3—
C、OH—、SO42—、HCO3—、AlO2— D、Mg2+、NH4+、SO42—、Cl—
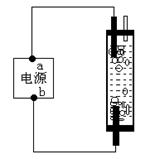 15、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
15、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A、a为正极,b为负极,NaClO和NaCl
B、b为正极,a为负极,NaClO和NaCl
C、a为阳极,b为阴极,HClO和NaCl
D、a为阴极,b为阳极,HClO和NaCl
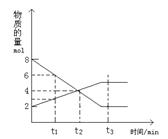 16、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
16、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A、反应的化学方程式为:2M ![]() N
N
B、t2时,正逆反应速率相等,达到平衡
C、t3时,正反应速率大于逆反应速率
D、t1时,N的浓度是M浓度的2倍
17、在相同的温度时100mL0.01mol/L的醋酸溶液与10mL0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A、中和时所需要NaOH的量 B、电离度
C、H+的物质的量 D、CH3COOH的物质的量
18、在常温下10mLPH=10的KOH溶液中,加入PH=4的一元酸HA到PH刚好等于7(假设反应前后体积的微小变化不计),则对反应后溶液的叙述正确的是
A、c(A-)=c(K+) B、c(H+)=c(OH-)<c(K+)<c(A-)
C、V总≥20mL D、V总≤20mL
请将选择题答案填在下表中
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷 (非选择题 共78分)
三、(本题包括2小题,共23分)
19、(13分)某学生利用氯酸钾催化分解制氧气的反应,测定氧气的摩尔质量。
实验步骤如下:
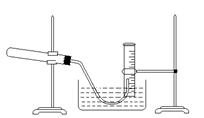 ①把适量的氯酸钾粉未和少量的二氧化锰粉未混合均匀,放入干燥的试管中,准确称量,质量为ag,
①把适量的氯酸钾粉未和少量的二氧化锰粉未混合均匀,放入干燥的试管中,准确称量,质量为ag,
②
③
④
⑤收集到一定量气体后,使导管出口高于液面(如图),再停止加热
⑥测量收集到气体的体积 ⑦准确称量试管和残留物的质量为bg
⑧把残留物倒入指定的容器中,洗净仪器,放回原处,保持桌面干净整洁。
⑨测量实验室温度 ⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)补充实验步骤②③④,使之完整。
(2)步骤⑤中必须这样操作的原因是为了 。
(3)以下是测量收集到气体体积必须包括的三个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是 。
(4)如果实验中得到的氧气的体积是cL(25℃、1.01×105Pa),水蒸气忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
20、(10分)第19题的实验结束时,老师让学生思考残留固体的利用方案。有学生提出,若前面实验中KClO3都已完全分解,则可用该残渣为原料制取氯化氢气体。
(1)对此他设计的实验步骤依次是:溶解、蒸发、结晶、制取气体。其中缺少的必要步骤是 。
(2)他开出的实验仪器和用品是:烧杯、烧瓶、蒸发皿、量筒、集气瓶、分液漏斗、酒精灯、药匙、托盘天平、铁架台、铁夹、铁圈、双孔橡皮塞、玻璃导管、火柴、蒸馏水、橡皮管。所缺少的必要试剂是 ,还缺少的必要的实验仪器用品是
。
(3)请你再提出一种该残留固体的利用方案:用该残留固体和 (一种必要的物质的名称)为原料制取 。
四、(本题包括2小题,共18分)
21、(8分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境中排放有害物质。例如:
|
 | |||||||||
(1)在上述有编号的各步中,需用还原剂的是 ,需用氧化剂的是 。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质的化学式是 。
(3)①步的化学方程式如下,请完成配平,并标出电子转移的方向和数目
![]() ( )Na2Cr2O7+( )KI+( )HCl ——( )CrCl3+(
)NaCl+( )KCl+( )I2+( )
( )Na2Cr2O7+( )KI+( )HCl ——( )CrCl3+(
)NaCl+( )KCl+( )I2+( )
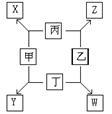 22、(10分)如图所示,已知:
22、(10分)如图所示,已知:
(1)甲、乙、丙、丁均为前三周期元素的单质。
(2)在一定条件下甲与丙和甲与丁都按物质的量之比为1:3反应,分别生成X和Y,在产物中元素甲呈负价。
(3)在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是
(2)甲与丙反应生成X的化学方程式是
(3)乙与丁反应生成W的化学方程式是
五、(本题包括2小题,共22分)
23、(14分)有机物J(C19H20O4)不溶于水,毒性低,与聚氯乙烯、聚乙烯等树酯具有良好的相溶性,是塑料工业的主要增塑剂,可用下列方法合成之。
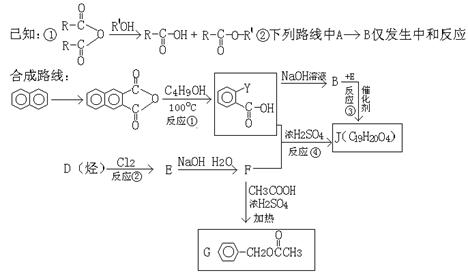
(1)②的反应类型 ,②的反应条件 ,④的反应类型
(2)写出结构简式:Y ,F 。
(3)B+E→J的化学方程式
(4)写出E的属于芳香烃衍生物的同分异构体的结构简式:
, , 。
(5)G有很多同分异构体,含有酯基和一取代苯结构的就有五个,其中三个是:
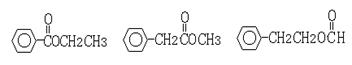
请写出另外两个同分异构体的结构简式: , 。
24、(8分)A、B都是芳香族化合物,1molA水解得到1molB和1molC醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B分子量之差是 。(2)1个B分子中应该有 个氧原子。
(3)A的分子式是 。(4)1molB最多消耗NaOH mol。
六、(本题包括2小题,共15分)
25、(5分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/mL的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以17.0计,水的密度以1.00g/mL计)
26、(10分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,试计算:
(1)该厂每小时消耗标准状况下空气的体积为多少m3?
(2)为满足题设要求,b%的下限是多少?