第四章 高三化学卤素一(氯及其化合物)
学习目标:了解氯气的物理性质、用途;掌握氯气的化学性质、实验室制法。通过氯及其化合物实验分析,提高设计与评价实验的能力和语言表达能力。通过新情境试题的剖析,提高自学能力。
疑难点拔:
1、应掌握以下问题:
(1)氯气的四个性质,即氯气与金属(氯气与变价金属反应,均使金属达到高价态)、非金属、还原性化合物、水或碱溶液反应。
(2)氯气的两种制法即氧化剂法(如实验室制法)、电解法(如工业制法)。
(3)盐酸的三种性质即酸性、氧化性、还原性。
(4)氯化氢的两种制法即燃烧法(如工业制法)、复分解法(如实验室制法)。
2、氯气与水反应实际上是可逆反应,因此氯水的成分较复杂。在考虑有关氯水参与的化学反应时要注意两点:
(1)氯水成分较复杂性造成氯水性质的多样性,要能正确判断所加物质与氯水中哪些成分发生了反应(如下表):氯水的成分和性质
| 成分 | 表现的性质 | 反应实例 |
| Cl2 | (1)强氧化性 (2)氯水呈黄绿色 (3)加成反应 | Cl2+Mg=MgCl2 Cl2+2KI=2KCl+I2 Cl2+H2SO3=H2SO4+2HCl Cl2+CH2=CH2→CH2Cl—CH2Cl |
| H+ | 强酸性 | 2H++CaCO3=Ca2++CO2↑+H2O |
| HClO | (1)弱酸性 (2)强氧化性 | HClO+OH-=ClO-+H2O 漂白、杀菌、消毒 |
| Cl- | 沉淀反应 | Cl2+H2O+AgNO3=AgCl↓+HNO3+HClO |
(2)![]() 平衡移动的应用:
平衡移动的应用:
| 向氯水中加入的物质 | 浓度变化 | 平衡移动的方向 | 应用 |
| 可溶性氯化物 | C(Cl-)增大 | 左移 | a、用饱和食盐水除Cl2中的HCl b、用排饱和食盐水法收集Cl2 |
| 盐酸 | C(H+)和C(Cl-)增大 | 左移 | 次氯酸与浓盐酸反应制Cl2 |
| NaOH | C(H+)减小 | 右移 | 用NaOH溶液吸收多余Cl2 |
| Ca(OH)2 | C(H+)减小 | 右移 | 制漂白粉 |
| CaCO3 | C(H+)减小 | 右移 | 制高浓度HClO溶液 |
| 光照 | C(HClO)减小 | 右移 | 氯水避光保存或现用现配 |
典型例题分析:
例1:写出下列物质与新制氯水反应的现象和化学方程式。①紫色石蕊试液 ②FeCl2溶液③AgNO3溶液 ④Na2CO3溶液 ⑤SO2通入氯水中 ⑥镁粉
。
例2:某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和ClO3-的浓度之比为1∶3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为:
A、21∶5 B、11∶3 C、3∶1 D、4∶1
例3:1998年,我国长江流域和松化江流域都有发生了百年不遇的特大洪水。灾区人民的饮用水,必须用漂白粉等消毒药品消毒后才能饮用,以防止传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失效。请写出失效过程中发生反应的化学方程式。
。
例4:已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 ;
(2)写出③中反应的化学方程式 ;
(3)写出④中反应的化学方程式 。
例5:由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,于人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时应尽量用稀有气体稀释,避免光照、震动或加热。
(1)在ClO2分子中,所有原子是否都有满足最外层8电子的结构? (填“是”或“否”)
(2)欧州一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半。表示这一反应的化学方程式是 。
(3)我国广泛采用将经干燥空气稀释所氯气,通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是 ,和欧州的方法相比,我国这一方法的主要优点是 。
(4)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2,表示这一反应的离子方程式是 ,此法的优点是 。
课堂练习:
1、自来水可以用氯气消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是:
A、AgNO3 B、FeCl3 C、Na2SO3 D、AlCl3
2、用自来水养金鱼时,通常先将自来水晒一段时间后,再注入鱼缸,其目的是:
A、利用紫外线杀死水中的细菌 B、提高水温,有利于金鱼生长
C、增加水中氧气的含量 D、促使水中的次氯酸分解
3、下列说法正确的是:
A、漂白粉的有效成分是氯酸钙 B、氯化氢在空气中呈白雾
C、碘化钾水溶液能使淀粉变蓝 D、氟气通入氯化钠水溶液中可制取氯气
4、甲、乙两瓶新制的氯水浓度均为0.1 mol/L ,如往甲瓶中加入适量的Na2CO3晶体,片刻后,甲、乙两瓶中HClO的物质的量浓度的关系是:
A、甲>乙 B、乙>甲 C、甲=乙 D、无法确定
5、为了防止污染,下列各组物质不能同时倒入废液缸内的有:
A、盐酸和碳酸钠溶液 B、硫酸钾溶液和氯化钡溶液
C、氯化钾溶液和氢碘酸 D、高锰酸钾溶液和盐酸
6、某同学在实验室用17.4g MnO2和50mL 8mol/L浓盐酸加热制Cl2,在常温常压下,该同学可制得Cl2:
A、2.24L B、0.2mol C、7.1g D、无法计算
7、原子团SCN化合价为 –1 价,在很多方面跟卤素原子相似,因此称为“拟卤素”。拟卤素离子与卤素离子还原性强弱顺序为Cl-<Br-<SCN-<I- 。下列反应错误的是:
A、(SCN)2+2Br-=Br2+2SCN- B、(SCN)2+2OH-=SCN-+SCNO-+H2O
C、4H++2SCN-+MnO2=Mn2++(SCN)2+2H2O D、(SCN)2+2I-=2SCN-+I2
8、双球洗气管是一种多用途仪器,常用于除去杂质、气体干燥、气体吸收(能防止倒吸等实验操作;下图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是:
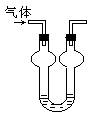 A、Cl2 B、HCl C、H2S D、CO2
A、Cl2 B、HCl C、H2S D、CO2
9、2000年5月底6月初,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断(这一判断的正确性有待证明):当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气(写出离子方程式): 。
10、化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
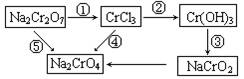 (1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号。
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)。
(3)完成并配平步骤①的化学方程式
__Na2Cr2O7+__KI+__HCl→__CrCl3+__NaCl+__KCl+__I2+____
11、将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通气后混合液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器及导管如下图。
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪 |
|
|
|
(1个) |
(1个) |
橡皮管 |
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 。
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 。
(3)仪器①的橡皮塞上应有 个孔,原因是 。
(4)实验时,仪器①中除观察到红光外还有 现象。
(5)实验时仪器②中制备Cl2和仪器①中ClO-与H2O2反应的离子方程式是:
。
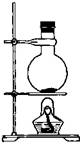
12、下图装置中,当浓HCl和重铬酸钾共热产生有色气体单质X,X经A、B两瓶后在C处与热的白色晶体反应,最后在D瓶有紫黑色晶体状物,回答下列问题:
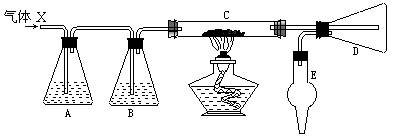 (1)制取X气体时,需要用到的玻璃仪器有
。
(1)制取X气体时,需要用到的玻璃仪器有
。
(2)若K2Cr2O7,被还原成Cr3+,写出制取X的化学方程式 。
(3)要得到纯净的X气体,A瓶盛放 ,B瓶应盛放 。
(4)C处的白色晶体是 ,D瓶的紫黑色晶体是 ,C处加热的目的是 。
(5)E装置盛碱石灰的作用是 。
13、已知氧化性Cl2>Br2>Fe3+。往500毫升2.0摩/升的FeBr2溶液中通入a摩氯气,试确定a不同取值范围时的氧化产物及其对应的物质的量,填入下表:
| a值的范围 | 氧化产物及其物质的量 |
| 0<a≤1/2 | |
| 1/2<a≤3/2 | |
| a≥3/2 |
参考答案:】
1、 BD 2、D 3、B 4、A 5、D 6、D 7、A 8.B
9、Cl- 和ClO- 酸性 Cl- + ClO- +2H+ =Cl2 + 2H2O
10、(1) ①,② (2)Cr(OH)3
(3)1 6 14 =2 2 6 3 7
11 、(1)②③⑤(2)②⑤④⑥④① (3)两 使 内外气流相同
(4)气泡 (5)4H+ + 2Cl- + MnO2 = Mn2+ + Cl2 + 2H2O
12、(1)酒精灯、圆底烧瓶、分液漏斗、导管
(2)K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
(3)饱和食盐水 浓硫酸
(4)KI I2 使Cl2与KI能反应,且使产生的I2升华进入D
(5)吸收多余的Cl2
13、 Fe3+: 2amol
Fe3+: 1mol Br2:(a-0.5)mol
Fe3+: 1mol Br2:1mol