![]()
|
|
学科:化学 |
| 教学内容:第八章 高三化学镁 铝 |
一、考纲要求
1.应用晶体结构有关知识、判断类型、推断性质.离子晶体、原子晶体、分子晶体、金属晶体构成了四种晶体结构基本类型;四种晶体类型构成的微粒不同,微粒间相互作用的强弱也不同,影响到晶体产生不同性质,特别是物理性质.如熔点、沸点、硬度、导电性、导热性等.反过来由晶体的性质也可推断晶体结构、判断晶体类型.(§2.1)
2.掌握镁、铝及其重要化合物的性质,相互转化规律.(§2.2)
3.掌握Al2O3、Al(OH)3两性的应用;掌握铝热剂和铝热反应.掌握Al(OH)3有关反应的定量关系,提高计算能力.(§2.3)
4.关于水的硬度及其计算.——是高考考查的较高层次的思维能力.(§2.4)
二、知识结构
1.几为常见晶体的辨析
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 | |
| 实 例 | NaCl晶体 | 金刚石 | 干冰 | 镁、铝 | |
| 构成晶体微粒 | 阴、阳离子 | 原子 | 分子 | 金属离子和自由电子 | |
| 相互作用 | 离子键 | 共价键 | 分子间作用力 | 金属离子与自由电子间较强作用较大 | |
| 性 质 | 硬度 | 较大 | 很大 | 很小 | 较大 |
| 熔、沸点 | 较高 | 很高 | 很低 | 多数较高 | |
| 导电性 | 熔化时或水溶解能导电 | 非导体 | 良导体 | ||
2.镁和铝的性质
物理性质
共性:密度小熔点较低,硬度较小银白色金属.
不同点:Al的上述性质都比镁略高.
化学性质
1.跟O2及其它非金属反应
常温下,在空气中都因生成氧化膜,具有抗腐蚀能力.
2Mg+O2![]() 2MgO
2MgO
4Al+3O2![]() 2Al2O3
2Al2O3
3Mg+N2![]() Mg3N2
Mg3N2
Mg+Br2![]() MgBr2
MgBr2
2Al+3S![]() Al2S3
Al2S3
2.跟某些氧化物
2Mg+CO2![]() 2MgO+C
2MgO+C
2Al+Fe2O3![]() 2Fe+Al2O3
(铝热反应)
2Fe+Al2O3
(铝热反应)
3.跟水反应
Mg+2H2O![]() Mg(OH)2+H2↑(冷水慢,沸水快)
Mg(OH)2+H2↑(冷水慢,沸水快)
2Al+6H2O![]() 2Al(OH)3+3H2↑(一般不反应,只有氧化膜被破坏后反应)
2Al(OH)3+3H2↑(一般不反应,只有氧化膜被破坏后反应)
4.跟酸的反应
Mg+2H+![]() Mg2++H2↑
Mg2++H2↑
2Al+6H+![]() 3Al3++3H2↑(常温下,在浓H2SO4、浓HNO3中钝化)
3Al3++3H2↑(常温下,在浓H2SO4、浓HNO3中钝化)
5.跟碱反应
2Al+2NaOH+2H2O![]() 2NaAlO2+3H2↑
2NaAlO2+3H2↑
3.镁和铝的氧化物的主要性质
MgO(碱性氧化物) Al2O3(两性氧化物)
物理性质
白色粉末、熔点高 白色固体、熔点高
化学性质
1.跟水的反应
MgO+H2O=Mg(OH)2(反应缓慢进行)
2.跟酸反应
MgO+2H+![]() Mg2++H2O
Mg2++H2O
Al2O3+6H+![]() 2Al3++3H2O
2Al3++3H2O
3.跟碱反应
Al2O3+2OH- ![]() AlO-2+2H2O
AlO-2+2H2O
4.镁和铝的氢氧化物的主要性质
Mg(OH)2(中强碱) Al(OH)3(两性氢氧化物)
物理性质
白色粉末难溶于水 白色固体,难溶于水
化学性质
1.跟酸反应
Mg(OH)2+2H+![]() Mg2++2H2O(可溶于NH4Cl等强酸弱碱盐)
Mg2++2H2O(可溶于NH4Cl等强酸弱碱盐)
Al(OH)3+3H+ ![]() Al3++3H2O
Al3++3H2O
2.跟碱反应
Al(OH)3+OH-![]() AlO-2+2H2O
AlO-2+2H2O
3.受热分解
Mg(OH)2 ![]() MgO+H2O
MgO+H2O
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
实验室制法
可溶性镁盐加NaOH溶液 Mg2++2OH- ![]() Mg(OH)2↓
Mg(OH)2↓
可溶性铝盐加氨水 Al3++3NH3·H2O![]() Al(OH)3↓+3NH+4
Al(OH)3↓+3NH+4
三、知识点、能力点提示
1.铝与强碱溶液反应的实质
反应过程:
2×3e
![]()
2Al+6H2O![]() 2Al(OH)3↓+3H2↑
2Al(OH)3↓+3H2↑
2Al(OH)3+2NaOH![]() 2NaAlO2+4H2O
2NaAlO2+4H2O
2×3e
![]()
总反应式: 2Al+2H2O+2NaOH ![]() 2NaAlO2+3H2↑
2NaAlO2+3H2↑
Al与水很难反应,且生成的Al(OH)3附在Al的表面,阻止了Al继续反应,但强碱NaOH能溶 解Al(OH)3,故可促使Al与强碱液反应,而弱碱如氨水,不溶解Al(OH)3,故Al在弱碱溶 液中不反应.
2.Al(OH)3的两性
在溶液中同时发生酸式电离和碱式电离.
Al(OH)3 ![]() H3AlO3
H3AlO3![]() HAlO2+H2O
HAlO2+H2O

Al3++3OH- AlO-2+H+
若向此溶液中加入酸,因H+与OH-结合生成水,反应向碱式电离方向进行,此时Al(OH)3是碱性,若加入碱,因OH-与H+结合生成水,故向酸式电离方向进行,这时Al(OH)3显酸性.
Al(OH)3溶解度很小,无论酸式或碱式电离的程度都很小,其碱性略强于酸性,故仍属于弱碱.
3.铝盐溶液与强碱溶液的反应.
(1)向AlCl3溶液中滴加NaOH溶液
①现象:白色沉淀![]() 沉淀增加
沉淀增加![]() 减少
减少![]() 消失
消失
②有关反应:
Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
Al(OH)3+OH- ![]() AlO-2+2H2O
AlO-2+2H2O
(2)向NaOH溶液中滴加AlCl3溶液
①现象:沉淀![]() 立刻消失,沉淀
立刻消失,沉淀![]() 沉淀增加
沉淀增加![]() 沉淀量不变
沉淀量不变
②有关反应:
Al3++3OH- ![]() Al(OH)3↓
Al(OH)3↓
Al(OH)3+OH-![]() AlO-2+2H2O
AlO-2+2H2O
Al3++3AlO-2+6H2O
![]() 4Al(OH)3↓
4Al(OH)3↓
四、能力训练
1.今有四种处于固态的物质:钠、硅、氖、氯化钠.问下列四项性质的叙述各属于哪种物质 ?(1)由分子间力结合而成,熔点很低.
(2)电的良导体,熔点在1000℃左右.
(3)由共价键组成的网状原子晶体.
(4)非导体、但熔融后可以导电.
知识点:晶体类型与物理性质间的关系.
能力点:概括能力、判断能力.
2.已发现的一百多种元素里,大约有![]() 是金属元素,其中:
是金属元素,其中:
(1)自然界中,最活泼的金属元素是 ;
(2)熔沸点最低的金属元素是 ;
(3)质量相同时,与足量的酸反应,放出H2的量最多的金属是 ;
(4)第三周期氧化性最强的离子是
知识点:从不同角度分析金属有关性质.
能力点:综合能力
3.向一个铝制易拉罐充满CO2气,然后往罐内注入足量的NaOH溶液,立即用胶布严封罐口,不多会儿听到罐内“卡卡”作响,发现易拉罐变瘪,再过一会易拉罐又鼓起来.
①易拉罐变瘪的原因 ,反应的离子反应式 ;
②易拉罐又鼓起来的原因 ,离子反应式
知识点:铝与碱液的反应
能力点:将理论知识运用于实际生活的能力.
4.不另加固体或液体物质,如何使含有a mol Al3+的A溶液中的铝元素和含有b mol AlO2-的B溶液中的铝元素全部转化为Al(OH)3沉淀?
知识点:NH3与Al3+,CO2与AlO2-的反应。
能力点:分解发散能力。
5.有一不纯的Mg条0.8g(杂质不能燃烧,且不溶于盐酸),在空气中充分燃烧,然后将生成物溶于50ml、1.8mol/L盐酸中,当往此溶液中加入0.2 mol/L的NaOH溶液90ml时,正好中和多余的盐酸,如再加入碱液360ml并加热,不但Mg2+完全沉淀,且放出134.4mlNH3(标准状况)
求:(1)写出有关反应式或离子反应式(7个)
(2)NH3多少摩?
(3)Mg3N2多少摩?
(4)MgO多少摩?
(5)Mg条中Mg的质量分数
知识点:镁及其化合物的一系列反应
能力点:阶梯发散思维.
6.氢化钠(NaH)是一种离子晶体,它与水反应生成碱和H2,现有NaH和Al粉混合物m(g),与 足量的水充分反应放出n(g)气体.
求下列条件下混合物中Al的质量
(1)x≥y(设NaH x mol,Al y mol)
(2)x<y
知识点:Al粉与其他混合物的反应
能力点:信息迁移能力
7.可能含有下列离子:K+、H+、Mg2+、OH-、CO2+3、Cl-、NO-3的某无色透明溶液,能与Al反应放出H2.
①若反应时Al转变成Al3+并放出H2,则该溶液中无 离子 ,一定有 离子,可能有 离子.
②若与Al反应后,向所得溶液中滴加盐酸,发现仅有白色沉淀生成,则该无色溶液中,一定 有 离子,一定无 离子,可能存在的离子有 .
知识点:Al与强酸或强碱液反应
能力点:综合能力
8.下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)不正确的是( )
(A)向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4
(B)向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液
(C)向烧碱溶液滴加明矾溶液
(D)向AlCl3溶液滴加过量氨水
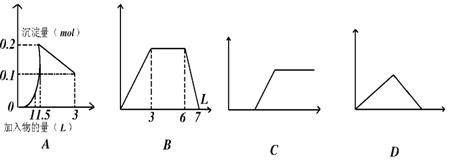
知识点:反应在图像中如何体现
能力点:数学与化学知识的有机结合
9.下列图示中,E是不溶于水的白色胶状物质。则:
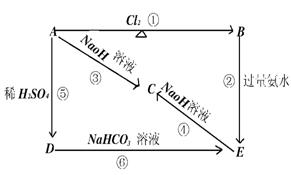
(A)化学式:
A B C
D E
(B)反应式或离子反应式.
① ② ③
④ ⑤ ⑥
知识点:框图,信息的运用
能力点:善于找突破口,展开逆向发散.
10.右图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得 沉淀ymol 与试剂体积V(ml)间的关系.以下结论不正确的是( )
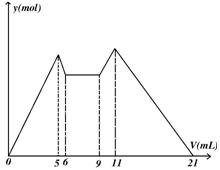
(A)A是盐酸,B是NaOH,且[B]=2[A]
(B)原混合液中,[Al3+]∶[Mg2+]∶[Cl-]=1∶1∶5
(C)A是NaOH,B是盐酸,且[NaOH]∶[HCl]=2∶1
(D)从6到9,相应离子反应式H++OH- ![]() H2O
H2O
知识点:Mg2+和Al3+与碱NaOH反应的差异
能力点:判断识图能力
11.关于ⅠA族和ⅡA族元素的下列说法中正确的是( )
A.在同一周期中,ⅠA族单质的熔点比ⅡA族高
B.浓度都是0.01 mol/L时,KOH溶液的pH比Ba(OH)2的小
C.氧化钠的熔点比氧化镁高
D.加热时,碳酸钠比碳酸镁易分解
知识点:对各主族元素性质的熟练掌握程度。
能力点:学会归纳比较的能力。
12.下列叙述中,一定是金属元素的是( )
A.原子的最外层只有一个电子的元素
B.易失去电子的物质
C.原子的最外层有两个电子的主族元素
D.单质具有金属光泽的元素
知识点:金属元素的有关性质
能力点:综合能力
13.已知工业上真空炼铷的反应方程式为:2RbCl+Mg![]() MgCl2+2Rb(g)
,对于此反应,能够进行正确解释的是( )
MgCl2+2Rb(g)
,对于此反应,能够进行正确解释的是( )
A.Rb比Mg金属性强
B.铷的沸点比镁的低,当把铷蒸气抽走时,平衡向正反应方向移动
C.MgCl2对热的稳定性比RbCl弱
D.高温下,Mg2+离子得电子的能力比Rb+离子弱
知识点:金属的还原性以及化学平衡方程。
能力点:比较迁移能力。
14.有关Al与NaOH溶液的反应的说法中,正确的是( )
A.铝是还原剂,其氧化产物是Al(OH)3
B.NaOH是氧化剂,其还原产物是H2
C.铝是还原剂,H2O和NaOH都是氧化剂
D.H2O是氧化剂,Al被氧化
知识点:Al与NaOH溶液反应的实质
能力点:追溯求源的能力
15.向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是( )
A.Cl- B.H+
C.OH- D.HCO-3
知识点:Al的化学性质及离子共存条件
能力点:综合能力
16.据报道:高温超导材料中,铊(Tl)是组成成分之一.
下列关于铊的性质判断,一定错误的是( )
A.铊是银白色质软的金属 B.Tl(OH)3是两性氢氧化物
C.Tl与Cl2化合能生成TlCl3 D.Tl的密度大于Al
知识点:新型材料铊的有关性质及元素周期律的知识.
能力点:类推能力
17.甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2(同温、同压下),则加入的铝粉的质量为( )
A.3.6g B.2.7g C.5.4g D.1.8g
知识点:铝分别与盐酸和氢氧化钠作用的性质。
能力点:培养学生综合计算能力。
18.A、B、C、D、E分别是Cu、Ag、Fe
Al、Mg五种金属中的一种,已知:①A、C均能与稀H2SO4反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体;④C、E在冷浓硝酸中发生钝化.由此可判 断A、B、C、D、E依次为( )
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
知识点:常见12种金属的性质
能力点:识忆和综合能力
19.由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在 标准状况下为11.2L,则混合物中一定含有的金属是( )
(A)锌 (B)铁 (C)铝 (D)镁
知识点:平均“摩尔电子质量”
能力点:学会化繁为简,找捷径.
20.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮料水,因缺少某些成分而不利 于少年儿童身体健康,你认为在制备上述商品饮料水时,至少还需要添加微量的化学物质( )
A.钙和镁的碳酸氢盐 B.小苏打
C.含碘酸盐的食盐 D.漂白粉等消毒剂
知识点:钙、镁等元素在生理上的作用。
能力点:理论联系实际的能力。
21.怎样软化含Mg(HCO3)2的硬水,写出有关反应式
知识点:硬水的软化方法.
能力点:综合能力
22.含有0.002mol NaCl的中性溶液100ml使之通过磺化煤酸型阳离子交换剂,令Na+完全转 化为H+,然后再用100ml,蒸馏水洗涤交换剂,所得混合液假设为200ml,求混合液的PH值 (PH=-lg[H+])
知识点:离子交换法
能力点:分解发散的能力
23.已知硬度的表示方法为:将水中Ca2+和Mg2+都看作Ca2+,并将其质 量折算成CaO的质量.通常把1L水中含有10mg CaO称为1度.18℃时,MgCO3的溶解度为0.0 11g,求该温度下,MgCO3饱和溶液的硬度相当于多少度?
知识点:有关硬度的计算.
能力点:理解信息和计算能力.

参考答案
【同步达纲练习】
1.①氖,②钠,③硅,④氯化钠
晶体![]() 结构晶体性质
结构晶体性质
2.①Cs ②Hg ③Be ④Al3+
Fr是放射性元素,故最活泼的金属是铯Cs
多数金属常温下都是固体,汞常温下是液体
铍Be与酸反应时,失去1mol电子的质量=![]() =4.5g/mol电子,故质量相 同时,放出H2最多.
=4.5g/mol电子,故质量相 同时,放出H2最多.
3.①NaOH溶液吸收CO2,罐内压强减小,外界大气压将罐压瘪.
CO2+2OH-![]() CO2+3+H2O
CO2+3+H2O
②Al片表面氧化膜先与碱作用无气体生成,而后Al与碱溶液作用放出气体,所以易拉罐变瘪后过一会儿才又鼓起来.
Al2O3+2OH- ![]() 2AlO-2+H2O
2AlO-2+H2O
2Al+2H2O+2OH-![]() 2AlO-2+3H2↑
2AlO-2+3H2↑
4.“不另加固体或液体物质”说明可以通入气体试剂。依题意通NH3可使溶液中的Al3+沉淀;通CO2气可使溶液中的AlO2-沉淀;也可用Al3+和AlO2- 在溶液中相混合产生沉淀的方法。
(1)设往A溶液中至少通入x mol NH3,则
Al3++3NH3+3H2O![]() Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
1 1
a x x=3a mol
(2)设往B溶液中至少通入y mol CO2,则
2AlO2-+CO2+3H2O
![]() 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
2 1
b y y=0.5b mol
(3)将A溶液与B溶液混合,则
Al3++3AlO2-+6H2O![]() 4Al(OH)3↓
4Al(OH)3↓
1 3
a b
讨论:①若b=3a,则混合后两溶液中的Al元素正好全部转化为沉淀;
②若b<3a,则只有AlO2-完全转化。
Al3++3AlO2-+6H2O ![]() 4Al(OH)3↓
4Al(OH)3↓
1 3
![]() b
b
则剩余Al3+(a- ![]() )mol,还需要通入NH3为3(a-
)mol,还需要通入NH3为3(a-![]() )=(3a-b)mol。
)=(3a-b)mol。
③若b>3a,则只有Al3+完全转化。
Al3++3AlO2-+6H2O![]() 4Al(OH)3
4Al(OH)3
1 3
a 3a
则剩余AlO2-(b-3a)mol,还需通入CO2气体为![]() mol。
mol。
5.(1)有关反应:
2Mg+O2 ![]() 2MgO
2MgO
3Mg+N2 ![]() Mg3N2
Mg3N2
MgO+2H+ ![]() Mg2++H2O
Mg2++H2O
Mg3N2+8H+ ![]() 3Mg2++2NH+4
3Mg2++2NH+4
H++OH- ![]() H2O
H2O
Mg2++2OH- ![]() Mg(OH)2↓
Mg(OH)2↓
NH+4+OH-![]() NH3↑+H2O
NH3↑+H2O
(2)NH3 ![]()
![]() =0.006mol
=0.006mol
(3)Mg3N2=0.003mol
(4)nMgO=0.024mol
(5)99%
6.(1)当x≥y时,Al完全反应
NaH+H2O![]() NaOH+H2↑
NaOH+H2↑
X x x
2Al+2H2O+2NaOH![]() 2NaAlO2+3H2↑
2NaAlO2+3H2↑
y 1.5y
![]()
∴y=![]() (12n-m)mol
(12n-m)mol
Al的质量=![]() (12n-m)×27=3(12n-m)(g)
(12n-m)×27=3(12n-m)(g)
(2)当x<y时,Al过量
NaH+H2O
![]() NaOH+H2↑
NaOH+H2↑
x x x
2Al+2H2O+2NaOH![]() 2NaAlO2+3H2↑
2NaAlO2+3H2↑
x 1.5x
![]()
∴y=![]() (m-4.8n)mol,Al质量为(m-48)(g)
(m-4.8n)mol,Al质量为(m-48)(g)
7.①CO2-3、OH-、NO-3;H+、Cl-;K+、Mg2+;
②OH-、K+;H+、Mg2+、CO2-3;NO-3
8.①在Ba(OH)2、NaAlO2混合液中滴入稀H2SO4,首先与Ba(OH)2,发生中和反应之后才与NaAlO2反应,因为在强碱液中不能形成Al(OH)3.
由消耗稀H2SO4的体积求沉淀的量.
②向AlCl3和NH4Cl混合液中加入NaOH液有如下反应关系:
Al3+ OH- Al(OH)3↓ OH- Al(OH)3 OH- AlO2-
0.1 0.3 0.1 0.3 0.1 0.1
NH+4 ![]() NH+4
NH+4![]() NH3·H2O
NH3·H2O![]() NH3·H2O
NH3·H2O
0.3 a 0.3 b 0.3
③C正确
④Al(OH)3在氨水中不溶解。
9.(A)化学式:A.Al B.AlCl3 C.NaAlO2
D.Al2(SO4)3 E.Al(OH)3
(B)有关反应式:
①2Al+3Cl2![]() 2AlCl3
2AlCl3
②Al3++3NH3·H2O![]() Al(OH)3↓+3NH+4
Al(OH)3↓+3NH+4
③2Al+2H2O+2OH- ![]() 2AlO-2+3H2↑
2AlO-2+3H2↑
④Al(OH)3+OH- ![]() AlO-2+2H2O
AlO-2+2H2O
⑤2Al+6H+![]() Al3++3H2↑
Al3++3H2↑
⑥Al3++HCO-3
![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
10.答案:(A)
本题将Al(OH)3![]() Al3+
Al3+ ![]()
![]()
![]() ,这一转化关系以曲线图的形式表现出
,这一转化关系以曲线图的形式表现出
来,要善于识图.
11.答案B
12.H原子最外层只有一个电子但为非金属,故A错误;易失电子的可以是金属也可是非金属 的阴离子,如S2-;具有金属光泽的也可能为非金属,如Si.
13.答案B
14.答案A、D.Al和NaOH溶液反应时,Al为还原剂,水为氧化剂,NaOH做为碱参与反应,所 以H2为还原产物,Al(OH)3为氧化产物.
15.投入Al片后放出氢气,则溶液中可能是强碱性也可能是酸性,而HCO-3既能和酸又能和碱溶液反应,所以HCO-3不能存在.故选D.
16.根据同族元素的性质递变规律知,Tl应是比Al更活泼的金属元素,则A、C、D的性质推断正确,B错误,故选B.
17.答案C.
18.答案C.
19.答案C.
①该混合金属的平均摩尔电子质量=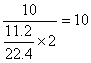
② 锌 铁 铝 镁
摩尔电子质量: 32.5 28 9 12
③按平均数的概念,该混合物中的两种金属的摩尔电子质量应分别小于和大于10,而小于10 的只有Al,故应选(C)
20.答案A
只溶有少量或不含Ca2+、Mg2+的水叫软水;明矾可净水而不能软化硬水;漂白 粉的成分有CaCl2和Ca(ClO)2等,使用漂白粉消毒的同时也增加了Ca2+;天然水 的硬度是泛指两种硬度之和.
21.解法一:加热法
Mg(HCO3)2![]() MgCO3↓+H2O+CO2↑
MgCO3↓+H2O+CO2↑
MgCO3+2H2O![]() Mg(OH)2↓+H2O+CO2↑
Mg(OH)2↓+H2O+CO2↑
解法二:石灰纯碱法
(A)先加入过量的石灰沉淀Mg2+
Mg(HCO3)2+2Ca(OH)2
![]() Mg(OH)2↓+CaCO3↓+2H2O
Mg(OH)2↓+CaCO3↓+2H2O
(B)再加纯碱沉淀过量的石灰中的Ca2+
Ca(OH)2+Na2CO3
![]() CaCO3↓+2NaOH
CaCO3↓+2NaOH
解法三:离子交换法
工业上常用磺化煤NaR为离子交换剂,表示如下:
2NaK+Mg2+ ![]() MgK2+2Na+
MgK2+2Na+
22.分三步完成:
①HK+Na+ ![]() NaK+H+
NaK+H+
0.002 0.002
②[H+]=![]() =10-2
=10-2
③PH=-lg10-2=2
23.解:1L水中含Mg2+=![]() =
=![]() (mol)
(mol)
![]() ÷
÷![]() =7.3度
=7.3度
