高三化学普通高校招生第一次模拟试题
化 学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至10页,共150分。考试时间120分钟。
第Ⅰ卷 (选择题,共72分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考生号填写在第二卷的相应位置。
2.每小题选出答案后,将答案填写在第二卷的答题卡上。
3.考试结束,监考人将本试卷和答题卷一并收回。
可能用到的原子量:Fe:56 S:32 O:16 H:1 N:14 Na:23
C:12 Ca:40 Mg:24 Cl:35.5 Cu:64
一、选择题(每小题只有一个选项符合题意,每小题4分,共32分)
1.元素M,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途: 炼钢,也大量用来制作干电池,还是动植物必需的微量元素。该元素为:
A.Mn B.Fe C.Cr D. Si
2.二氧化硫气体的排放是形成酸雨的主要原因。二氧化硫主要来源于含硫燃料的燃烧。为了减少酸雨的形成,在含硫较多的煤中搀入一定量的生石灰或石灰石,此煤燃烧后硫元素的主要存在形式是:
A.CaS B.SO3 C.CaSO3 D.CaSO4
3.在下列各说法中都包含有前后两个数值,其中前者小于后者的是:
A.质量分数为20%的氨水与质量分数为10%的氨水的密度
B.熟石灰在20℃时与60℃时的溶解度
C.红磷与白磷的着火点
D.金属锂与金属铷的熔点
4.某学生做完实验以后,采用下列方法分别清洗所用仪器:
①用稀硝酸清洗做过银镜反应的试管;
②用酒精清洗做过碘升华的烧杯;
③用浓盐酸清洗做过高锰酸钾分解实验的试管;
④用盐酸清洗长期存放过三氯化铁溶液的试剂瓶;
⑤用氢氧化钠溶液清洗盛过苯酚的试管。
你认为他的操作:
A.②不对 B.③④不对 C.④⑤不对 D.全部正确
5.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是:
A.Fe3+、CI-、Na+、SO42- B.Al3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3- D.AlO2-、CO32-、K+、Na+
6.FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为:
A.2a% B.3a% C.1-2a% D.1-3a%
![]() 7.在一定条件下,可逆反应X(气)+3Y(气) 2Z(气) 达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比为:
7.在一定条件下,可逆反应X(气)+3Y(气) 2Z(气) 达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X、Y的物质的量之比为:
A.1:3 B.3:1 C.3:2 D.1:2
8.某烃的衍生物分子式可写成(CH2)m(CO2)n(H2O)p,当它完全燃烧时,生成的CO2与消耗的O2在同温同压下体积比为1:1,则m、n比值为:
A.1:1 B.2:3 C.1:2 D.2:1
二、选择题(每小题4分,共40分,每小题有一个或两个选项符合题意。)
9.设N表示阿伏加德罗常数的值。下列说法不正确的是:
A.1mol醋酸的质量与NA个醋酸分子的质量相等
B.NA个氧分子和NA个氢分子的质量比等于16∶1
C.28 g氮气所含的原子数目为NA
D.在标准状况下,0.5NA个氯气分子所占体积约是11.2 L
10.向下列溶液中通入过量CO2最终出现浑浊的是:
A.氢氧化钙饱和溶液 B.苯酚钠饱和溶液
C.醋酸钠饱和溶液 D.氯化钙饱和溶液
11、下列离子方程式的书写正确的是:
A.过量二氧化碳通入偏铝酸钠溶液中:
CO2 + 2H2O + AlO2– ==== Al(OH)3↓+ HCO3–
B.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:
NH4+ + HSO3– + 2OH– ==== SO32– + NH3↑+ 2H2O
C.氯气通入冷的烧碱溶液中:
2Cl2 + 2OH– ==== 3Cl– + ClO– + H2O
D.硫酸氢钠溶液中加入碳酸氢钠溶液:
H+ + HCO3– ==== CO2↑+ H2O
12.目前人们正在研究开发一种高能电池——钠硫电池。它是以熔融的金属钠、单质硫为两极,以Na+导电,![]() —AI2O3陶瓷作固体电解质,反应如下:2Na + xS == Na2Sx,以下说法正确的是:
—AI2O3陶瓷作固体电解质,反应如下:2Na + xS == Na2Sx,以下说法正确的是:
A.放电时钠作正极,硫作负极
B.放电时,钠发生还原反应
C.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连
D.充电时,阳极发生反应:S![]() –2e == xS
–2e == xS
13.在t℃时,CuSO4的溶解度为A g,在该温度时,向(100+A) g饱和CuSO4溶液中加入A g无水CuSO4粉末后,得到一定量的蓝色CuSO4晶体。取出该晶体投入多少克水中,才能使溶液在t℃时恰好饱和:
A.100 g B.(100+A) g C.(100+2A) g D.无法计算
14.用高铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮用水处理的一种新技术,下列对Na2FeO4用于饮用水消毒处理的分析正确的是:
A.Na2FeO4在溶液中显强酸性,能消毒杀菌
B.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C.Na2FeO4的还原产物Fe3+水解为 Fe(OH)3胶体,可使水中悬浮物凝聚沉降
D.Na2FeO4的还原产物Fe2+水解为Pe(OH)2胶体,可使水中悬浮物凝聚沉降
15.下列分子中所有原子都满足最外层8电子结构的是:
A.六氟化氙 (XeF6) B.次氯酸(HClO)
C.氯化硫(S2Cl2) D.三氟化硼(BF3)
16.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡是有一个手性碳原子的物质一定具有光学活性。例如,有机化合物:![]() 有光学活性,它分别发生下列反应:①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是:
有光学活性,它分别发生下列反应:①与甲酸发生酯化反应,②与NaOH水溶液共热,③与银氨溶液作用,④在催化剂存在下与H2作用后,生成的有机物无光学活性的是:
A.①② B.②③ C.②④ D.③④
17.已知氮的氧化物踉NaOH溶液发生的化学反应如下:
3NO2+2NaOH=2NaNO3+NO↑+H2O NO2+NO+2NaOH=2NaNO2+H2O
现有m mol NO2和n mol NO组成的混合气体,要用NaOH溶液使其完全吸收无气体剩余,现有浓度为a mol/L的NaOH溶液,则需此NaOH溶液的体积为:
A.![]() L B.
L B.![]() L C.
L C.![]() L D.
L D.![]() L
L
18.下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应,就不可以将它们区别开的是:
A.硝酸钾 硫酸钠 氯化铜 氯化钡
B.硫酸 硫酸铝 氯化钠 氢氧化钠
C.氯化钡 硫酸钠 碳酸钠 氢氧化钠
D.硫酸镁 碳酸钠 硫酸氢钠 氢氧化钠
普通高校招生第一次模拟试题
![]() 化 学
化 学
考生号 姓名 区县(市)
第一、二选择题答题卡(每小题4分,1–8为单选题,9–18为1–2项选择题,少选得2分,多选或选错得0分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共78分)
注意事项:第Ⅱ卷共6页,用钢笔或圆珠笔直接答在试题卷上。
| 题号 | 三 | 四 | 五 | 六 | 总分 |
| 分数 |
三、(本题包括2小题,共19分)
19.(2+2+3=7分)用滴管将新制的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液(样品)中,当滴到最后一滴时红色突然褪去。产生该现象的原因可能有两个:
(1)是由于 ;(2)是由于 。
简述怎样用实验证明红色褪去的原因是(1)或者(2):
。
20.(2+1+1+1+2+2+1+2=12)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3,10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0 g和212 g,常温下从溶液中析出的晶体是Na2S2O3·5H2O,Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3 + 2HCI=S↓+ SO2↑+ H2O十2NaCI
现取15.1 gNa2SO3,溶于80.0 mL水。另取5.00 g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中,用小火加热至微沸,反应约1小时后过滤,滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是 (填写选项的字母,可以多选,但选错要倒扣分)
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
(2)反应1小时后过滤,其目的是 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机物质是 ,它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是
。
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)。
(5)若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所得到的Na2S2O3·5H2O的质量,你认为 。(填写一个选项的字母)
A.前面提供的数据已经足够
B.还需要提供100℃时溶液的密度(1.14g·cm-3)
C.还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选A直接计算,如选B或C则可选用其数据),计算从10℃,30mL溶液中结晶而出的Na2S2O3·5H2O的质量 。
四、(本题包括4小题,共27分)
21.(2+1+1+2=6分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取单质氟的尝试一直未获成功。直到1985年,Karl Christe终于由氟化物制出F2。他提出的三步反应如下,请将(1)、(3)两反应配平,并填写有关空白。
(1) KMnO4+ KF+ HF+ H2O2 ==== K2MnF6+ O2+ H2O,此反应中,氧化剂是 ,氧化产物是 。
(2)SbCI5 + 5HF ==== SbF5 + 5HCI
(3) K2MnF6+ SbF5 ==== KSbF6+ MnF3+ F2
22.(1+1+1+1+2+1+1+2=10分)A、B、C、D是4种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍,这4种元素的单质中有2种是气体、2种是固体。
(1) 写出元素符号:A 、B 、C 、D 。
(2) 写出2种均含A、B、C、D四种元素的化合物相互反应逸出气体的化学方程式:
;
(3) 写出A和B、B和C按照原子个数比为1:1形成的化合物的电子式: 、 。
(4) 用A的单质和B的单质可以制成电池,电池中装有浓KOH溶液,用多孔的金属惰性电极浸入KOH溶液中,两极均有特制的防止气体透过的隔膜,在一极通入A单质,另一极通入B单质,通入B单质的一极其电极反应方程式为: 。
23.据2000年4月出版的《参考消息》报道:美国硅谷已成功开发出分子计算机,其中主要器件为分子开关和分子导线。Gokel教授研制了氧化还原型电控分子开关——蒽醌套索醚电控开关。它是通过电化学还原使冠醚“胳膊”阴离子化,从而加强对流动阳离子的束缚力,达到“关”的作用;再借助氧化反应使其恢复到原来的“开启”状态,使阳离子顺利流动:
|
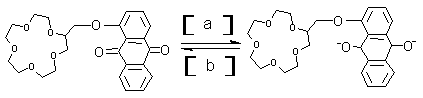
(1)在括号中填写反应类型(填氧化反应、还原反应):a 反应,b 反应。
(2)若分子计算机中分子开关处于A状态,则计算机处于 状态,若分子计算机中分子开关处于B状态,则计算机处于 状态(填“开启”或“关闭”)。
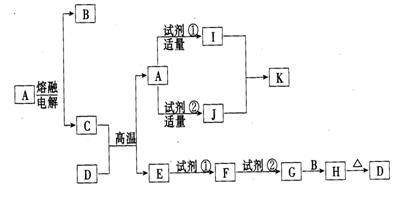
24.(1+1+1+2+2=7分)下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部注明)。根据图示转化关系填写下列空白:
(1)写出下列物质的化学式:A_ __;D_ __。
(2)C粉末与D的混合物通常叫_ __(填名称)。
(3)写出I +J → K的离子方程式_ _。
(4)写出G → H的化学方程式_ __。
五、(本题包括2小题,共18分)
|
|
25.(1) (每空1分,共5分)有机物A的碳架结构如图所示,
其分子式为
,已知立方烷(C8H8)与![]()
互为同分异构体,请写出跟A互为同分异构体、具有一个苯
环、且属于醛类的结构简式: 、 、
、 。
(2)实验室制备酚醛树脂的主要步骤如下:
a. 在大试管中加入2.5 克苯酚和2.5 毫升40% 的甲醛溶液。
b. 再加入1毫升浓盐酸,并把实验装置好。
c. 将试管水浴加热至沸腾,反应不再剧烈进行,过一会儿便可停止加热。
d. 取出试管中的粘稠固体,用水洗净得到产品。
填写下列空白(2+1+1=4分):
①在装置中,试管口加一带塞的直导管的作用是_ _ _。
②加入浓盐酸的作用是_ _,还可用_ __代替盐酸。
![]()
![]()
![]()
![]() 26.(2+2+1+1+3=9分) 已知:(CH3)2CHCOOR CH2=C(CH3)COOR
26.(2+2+1+1+3=9分) 已知:(CH3)2CHCOOR CH2=C(CH3)COOR
RCH=CH2
RCH(CH3)CHO
今有A、B、C、D、E、F六种有机物,它们所含的元素不超过C、H、O三种,这六种有机物的转化关系如下:A
B C ®
![]() D
E
D
E![]() F
F
其中A和D摩尔质量分别是82 g/mol和202 g/mol。A是无支链的烃;B可发生银镜反应;C可被碱中和;D无酸性;而F是高分子化合物,其化学式是(C10H14O4)n。试回答:
(1)结构简式:A ;E 。
(2)反应类型:C®D是 ;E®F是 。
(3)化学方程式:B与足量新制的Cu(OH)2悬浊液在加热时反应:
。
六、(本题包括2小题,共14分)
27.(7分)把a mol NH3、O2组成的混合气体导入密闭容器中,在催化剂存在下发生化学反应。若混合气体中O2为x mol,反应生成的HNO3为y mol。
(1) 试写出生成硝酸的总反应方程式?
(2) 试确定O2的物质的量x取不同取值范围时,HNO3的物质的量y的计算式?
28.(7分)在100 毫升FeCl2 溶液中通入一定量的Cl2 气,然后在溶液中加入2 摩/升 NaOH 溶液125 毫升。充分反应后,将沉淀滤出,在滤液中加1.5 摩/升盐酸20 毫升,溶液恰好呈中性。把滤出的沉淀在空气中放置一段时间,放在坩埚中加热,最后得到的固体物质的质量为8 克,试求FeCl2 的物质的量浓度?
27.解:
28.解: