![]()
|
|
学科:化学 |
| 教学内容:高三化学期末综合试题 |
【同步达纲练习】
一、选择题(本小题包括18小题,每小题4分,共72人分。每小题![]() 选项符合题意。)
选项符合题意。)
1.环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息,这些污染物是
A.稀有气体、氮氧化物、二氧化碳、可吸入颗粒物、臭氧
B.二氧化硫、二氧化氮、二氧化碳、可吸入颗粒物、臭氧
C.三氧化硫、氮氢化物、一氧化碳、可吸入颗粒物、臭氧
D.二氧化硫、二氧化氮、一氧化碳、可吸入颗粒物、臭氧
2.将![]() 与过量的液氨反应可生成化合物
与过量的液氨反应可生成化合物![]() 。将该化合物在无氧条件下高温灼烧,可得到氮化硅
。将该化合物在无氧条件下高温灼烧,可得到氮化硅![]() 固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。则氮化硅所属的晶体类型是
固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。则氮化硅所属的晶体类型是
A.原子晶体 B.分子晶体
C.离子晶体 D.金属晶体
3.常温下某种溶液中由水电离出的![]() ,该溶液中的溶质不可能是
,该溶液中的溶质不可能是
A.![]() B.
B.![]()
C.NaOH D.HCl
4.下列芳香烃的一氯取代物的同分异构体数目最多的是

5.用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为
A.量筒 B.容量瓶
C.滴定管 D.以上均不对
6.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A.原子半径A<B<C
B.B的氧化物的熔点比A的氧化物低
C.A的氢化物的稳定性大于C的氢化物
D.A与C可形成离子化合物
7.某无色透明的溶液,在pH=0 和pH=14条件下都能大量共存的是
A.![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]()
8.下列反应的离子方程式中![]() 的是
的是
A.氨气通入甲酸溶液中:
![]()
B.用碳棒作电极电解氯化钠饱和溶液:
![]()
C.过量二氧化碳通入偏铝酸钠溶液中:
![]()
D.用氨水吸收少量二氧化硫:
![]()
9.某温度下,在容积固定的密闭容器中发生可逆反应![]() 。平衡时,各物质的浓度比为c (A)∶c (B)∶c (Q) =1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
。平衡时,各物质的浓度比为c (A)∶c (B)∶c (Q) =1∶1∶2,保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
A.刚充入时反应速率![]() 减少,
减少,![]() 增大
增大
B.达到新的平衡时,反应混合物中A、B的物质的量分数增加
C.达到新的平衡时 c (A)∶c (B)∶c (Q)仍为1∶1∶2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
10.生物体中细胞内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是
A.负极发生的电极反应可能是:
![]()
B.正极发生的电极反应可能是:
![]()
C.负极反应主要是![]() 生成
生成![]()
D.正极反应主要是![]() 生成
生成![]()
11.1999年4月,核化学家在回旋加速器上用高![]() Kr离子轰
Kr离子轰![]() Pb靶,氪核与铅核融合,放出1个中子,生成
Pb靶,氪核与铅核融合,放出1个中子,生成![]() 原子,在120μs后,该核分裂出1个 α粒子(即氦原子核),衰变成另一个新核
原子,在120μs后,该核分裂出1个 α粒子(即氦原子核),衰变成另一个新核![]() 。已知118号新元素位于周期表第0族,则下列说法正确的是
。已知118号新元素位于周期表第0族,则下列说法正确的是
(A)116号元素属于第八周期元素
(B)自然界中存在118号和116号元素
(C)![]() 原子的中子数为289
原子的中子数为289
(D)![]() 原子的中子数为175
原子的中子数为175
12.常见的离子晶体类型有5种,如图是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为
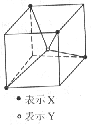
A.4∶1 B.2∶1
C.1∶1 D.1∶2
13.我国国家药品监督管理局在2000年11月16日发出紧急通知,立即禁止使用含PPA的抗感冒药物。PPA是盐酸苯丙醇胺的英文缩写,已知苯丙醇胺的结构简式如下:
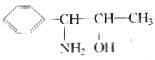
下列对苯丙醇胺的叙述![]() 的是
的是
A.一定条件下,可以发生消去反应
B.一定条件下与![]() 可以发生苯环的取代反应
可以发生苯环的取代反应
C.具有弱碱性,可与强酸反应生成盐
D.具有弱酸性,可与强碱反应生成盐
14.用铁酸钠![]() 对来自河湖的淡水消毒是城市饮水处理新技术,下列对
对来自河湖的淡水消毒是城市饮水处理新技术,下列对![]() 用于饮水消毒处理的分析正确的是
用于饮水消毒处理的分析正确的是
A.![]() 在溶液中显强碱性,能消毒杀菌
在溶液中显强碱性,能消毒杀菌
B.在![]() 中Fe为+6价,具有强氧化性,能消毒杀菌
中Fe为+6价,具有强氧化性,能消毒杀菌
C.![]() 的还原产物
的还原产物![]() ,易水解为
,易水解为![]() 胶体,可使水中悬浮物凝聚沉降
胶体,可使水中悬浮物凝聚沉降
D.![]() 的还原产物是
的还原产物是![]() ,易水解为
,易水解为![]() ,可使水中悬浮物凝聚沉降
,可使水中悬浮物凝聚沉降
15.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
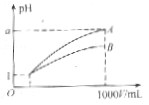
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
16.同温度下的两种醋酸甲和乙,甲溶液的浓度为![]() ,电离度为
,电离度为![]() ,pH为
,pH为![]() ;乙溶液中
;乙溶液中![]() 为
为![]() ,电离度为
,电离度为![]() ,pH为
,pH为![]() ,则下述结论中,
,则下述结论中,![]() 的是
的是
A.乙溶液中的![]() 是甲溶液中
是甲溶液中![]() 的
的![]()
B.乙溶液中的醋酸的物质的量浓度可表示为![]()
C.![]() >
>![]()
D.![]() <
<![]()
17.在一个容积为VL的密闭容器中放入2升A(气)和1升B(气),在一定条件下发生下列反应:
![]() 达到平衡后,A物质的量浓度减少
达到平衡后,A物质的量浓度减少![]() ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大![]() ,则该反应的化学方程式中n的值是
,则该反应的化学方程式中n的值是
A.1 B.2 C.3 D.4
18.某二元弱酸的酸式盐NaHA溶液,若pH<7则溶液中各离子的浓度关系不正确的是
A.![]()
B.![]()
C.![]()
D.![]()
二、(本题包括2小题,共计20分)
19.(8分)用铂电极电解氢氧化钠溶液,测定两极逸出气体的体积,记录如下:
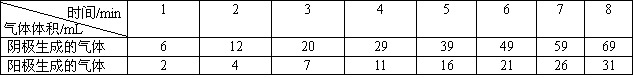
(1)完成有关的电极反应式:阴极___________________,阳极____________________。
(2)完成电解池总化学方程式_________________________________。
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是
_____________________,________________。
(4)自第几分钟起阴极与阳极产生气体的体积比约为理论的比值?_________________
20.(12分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的![]() 悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
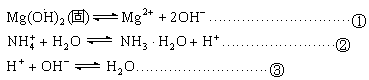
由于![]() 水解显酸性,
水解显酸性,![]() 与Mg
与Mg![]() 反应生成水,导致反应①平衡右移,沉淀溶解;乙同学解释是:
反应生成水,导致反应①平衡右移,沉淀溶解;乙同学解释是:
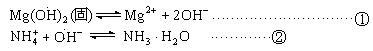
由于![]() 电离出的
电离出的![]() 与
与![]() 电离出的
电离出的![]() 结合,生成了弱的电解质
结合,生成了弱的电解质![]() ,导致反应①的平衡右移,
,导致反应①的平衡右移,![]() 沉淀溶解。
沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是_______________________(填写编号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)请你说明丙同学作出该选择的理由
___________________________________________
____________________________________________。
(3)丙同学将所选试剂滴入![]() 的浊液中,
的浊液中,![]() 溶解;由此推知,甲和乙哪位同学的解释更合理____________________(填“甲”或“乙”);完成
溶解;由此推知,甲和乙哪位同学的解释更合理____________________(填“甲”或“乙”);完成![]() 饱和溶液使
饱和溶液使![]() 悬浊液溶解的离子方程式___________________________。
悬浊液溶解的离子方程式___________________________。
三、(本题包括2小题共计18分)
21.麻醉剂的发现和使用,是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛。
(1)笑气是人类最早应用于医疗的麻醉剂之一,它可由![]() 在微热条件下分解产生,产物除
在微热条件下分解产生,产物除![]() 外还有一种,此反应的化学方程式为______________________________(标出电子转移的方向和数目)。有关理论认为
外还有一种,此反应的化学方程式为______________________________(标出电子转移的方向和数目)。有关理论认为![]() 与
与![]() 分具有相似的结构(包括电子式),已知
分具有相似的结构(包括电子式),已知![]() 分子中氧原子只与一个氮原子相连,则
分子中氧原子只与一个氮原子相连,则![]() 的电子式可表示为_____________,其空间构型是_____________________型。
的电子式可表示为_____________,其空间构型是_____________________型。
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,为了防止事故,使用前可用于检验氯仿是否变质的试剂是________________。
,为了防止事故,使用前可用于检验氯仿是否变质的试剂是________________。
A.淀粉一碘化钾溶液
B.NaOH溶液
C.酚酞溶液
D.硝酸酸化的![]() 溶液
溶液
(3)氯普鲁卡因盐酸盐是一种局部麻醉剂,麻醉作用较快,较强,毒性较低,其结构简式为 ,它可以以甲苯为原料,先经过___________________反应合成
,它可以以甲苯为原料,先经过___________________反应合成![]() ,再经过________________反应来合成
,再经过________________反应来合成![]() ,再经过一系列反应来合成。(填反应类型)
,再经过一系列反应来合成。(填反应类型)
(4)作为麻醉剂,氙气在医学上也生受重视,氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止。人们曾试用体积分数为80%的氙气和20%的氧气组成的混合气作为无副作用的麻醉剂。
氙在元素周期表中位于___________周期,________族,此麻醉剂的平均式量为________。
22.(8分)有![]() 、
、![]() 、
、![]()
![]() 和Q、R六种微粒,它们都含有氢原子,且微粒中都含10个电子;
和Q、R六种微粒,它们都含有氢原子,且微粒中都含10个电子;![]() 和
和![]() 在加热反应生成Q气体和R液体:R在常温下发生很弱电离生成
在加热反应生成Q气体和R液体:R在常温下发生很弱电离生成![]() 和
和![]() ;Q在低温液态时有极微弱电离生成
;Q在低温液态时有极微弱电离生成![]() 和D-。
和D-。
(1)写出![]() 、
、![]() 的电子式:
的电子式:![]() ____________,
____________,![]() __________;
__________;
(2)写出![]() 与
与![]() 加热反应的离子方程式________________________;
加热反应的离子方程式________________________;
(3)写出Q在低温液态时电离的方程式__________________________________。
四、(本题包括2小题共计20分)
23.(8分)下面是一种“三肽”,它可以看作是3个氨基酸缩合而得的产物:
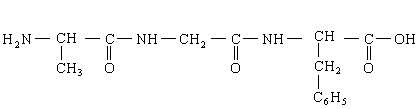
(1)它完全水解的生成物是(写结构简式):___________________。
(2)现在一种“十二肽”,分子式为![]() (Z>12)已知将它彻底水解后只得到下列氨基酸:
(Z>12)已知将它彻底水解后只得到下列氨基酸:
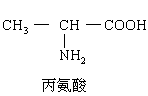
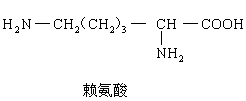
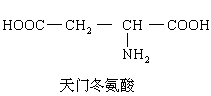
将一个该“十二肽”分子彻底水解后,有____________个赖氨酸生成:
将一个该“十二肽”分子彻底水解后,有_____________个天门冬氨酸生成。
24.(12分)已知,葡萄糖在乳酸菌的催化作用下可转化为乳酸![]() 。
。
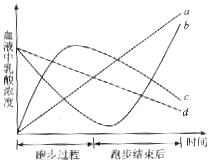
(1)上图中能够说明运动员在短跑从开始到结束后血液乳酸浓度变化的曲线__________。
(2)人体剧烈运动后,往往会感到肌肉酸痛,其原因是肌肉中__________________。
(3)取9.0g乳酸与足量金属钠反应,可产生2.24L气体(标准状况)。另取9.0g乳酸与等物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g![]() 。乳酸在铜做催化剂时,可氧化成物质X,向X中加入碱和银氨溶液微热,无银产生。由以上实验可确定X的结构简式是_________________________________,乳酸的结构简式是____________________。
。乳酸在铜做催化剂时,可氧化成物质X,向X中加入碱和银氨溶液微热,无银产生。由以上实验可确定X的结构简式是_________________________________,乳酸的结构简式是____________________。
(4)近年来,乳酸成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。利用乳酸聚合而成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中,都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
①写出乳酸在一定条件下发生缩聚反应的化学方程式:________________。
②用乳酸聚合的纤维(聚乳酸)非常合适于做手术缝合线,尤其是做人体内部器官的手术,试分析其中的原因__________________________________________________。
③试从生物学物质循环的角度解释利用乳酸合成高分子材料,对于环境有什么重要意义?
__________________________________________________________________________。
五、(本题包括2小题,共计20分)。
25.(10分)甲状旁腺是人体内最小的腺体之一,共有两对,位于甲状腺的背面或在甲状腺之中。它分泌的甲状旁腺素对血钙的调节有巨大作用。切除狗的甲状旁腺后会出现全身性痉挛。为测得此时狗血液中的血钙浓度,可设计以下方案:取20.00mL血液,稀释后用![]() 溶液处理,使
溶液处理,使![]() 生成
生成![]() 沉淀,沉淀过滤洗涤后溶解于强酸中,然后用0.0100
沉淀,沉淀过滤洗涤后溶解于强酸中,然后用0.0100![]() 的
的![]() 溶液滴定,发生的离子反应为:
溶液滴定,发生的离子反应为:
![]() ,共用去1.20mL
,共用去1.20mL![]() 溶液。
溶液。
(1)试计算此血液中血钙的含量(mg/100mL);
(2)已知正常时狗血液中血钙含量为10mg/100mL,根据计算结果,请推测甲状旁腺素对血钙的调节有何作用。
26.(10分)有一平均相对分子质量为30.4的CO、![]() 和
和![]() 的混合气体,经点燃完全反应后,测得反应后混合气体中不再有CO和
的混合气体,经点燃完全反应后,测得反应后混合气体中不再有CO和![]() 。试通过计算求:
。试通过计算求:
①原混合气体中氧气所占的体积分数为多少?
②原混合气体中一氧化碳和乙烯的体积分数的取值范围(用百分比表示)

参考答案
【同步达纲练习】
一、选择题
1.D 2.A 3.B 4.B 5.C 6.C 7.C 8.D 9.D 10.C 11.D 12.D 13.D 14.B 15.A 16.D 17.A 18.C
二、(共20分)
19(8分)
(1)![]() ,
,![]() (每空1分)
(每空1分)
(2)![]() (2分)
(2分)
(3)开始阶段![]() 和
和![]() 在水中未达到饱和(1分),
在水中未达到饱和(1分),![]() 在水中的溶解度比
在水中的溶解度比![]() 大(1分)
大(1分)
(4)4min(2分)
20(12分)(1)B (4分)
(2)![]() 溶液呈中性(2分);滴入Mg
溶液呈中性(2分);滴入Mg![]() 悬浊液,若Mg
悬浊液,若Mg![]() 悬浊液溶解,则说明乙同学解释正确,若Mg
悬浊液溶解,则说明乙同学解释正确,若Mg![]() 不溶,则甲同学解释正确(2分)
不溶,则甲同学解释正确(2分)
(3)乙(2分);![]() (2分)若写“
(2分)若写“![]() ”则只得1分。
”则只得1分。
三、(共18分)
21(12分)
(1)![]() (化学方程式2分,电子转移方向数目均正确得1分,共计3分);
(化学方程式2分,电子转移方向数目均正确得1分,共计3分);![]() (1分);直线(1分)
(1分);直线(1分)
(2)D(2分)
(3)硝化(取代)、氧化(各1分)
(4)五、0、111.2(每空1分)
22.(6分)
(1)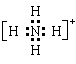 、
、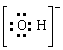 (每空1分)
(每空1分)
(2)![]() (2分)
(2分)
(3)![]() (2分)
(2分)
四、(共20分)
23.(8分)
(1)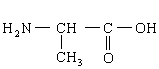 ,
, 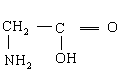 ,
,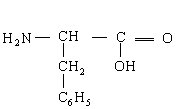
(每个结构简式1分)
(2)Z-12(2分)
(3)![]() (3分)
(3分)
24.(12分)
(1)C(1分)
(2)乳酸浓度升高(1分)
(3)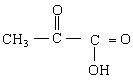 (2分)
(2分)
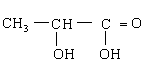 (2分)
(2分)
(4)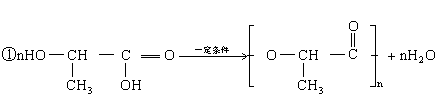 (2分)
(2分)
②聚乳酸本身对人体无毒,在体内可以水解为乳酸,最后降解为水和二氧化碳通过人体呼吸或排泄系统排出体外,故不需要二次开刀拆线。(2分)(只需答出降解为水和二氧化碳,便可得2分。)
③二氧化碳和水通过植物的光合作用合成淀粉,淀粉发酵生成乳酸,由乳酸合成的聚乳酸在体内最终降解为水和二氧化碳,对环境无污染人类利用自然界实现二氧化碳和水的循环。(2分)
五、(共20分)
25.(10分)
(1)![]() (1分)
(1分)
设20mL血液中![]() 的物质的量为x。
的物质的量为x。
关系式:![]() (2分)
(2分)
2 mol 5 mol
![]() x
x
![]() (2分)
(2分)
100mL血液中![]() (1分)
(1分)
100mL血液中W![]() (1分)
(1分)
(2)提高血液![]() 中
中![]() 的含量。(3分)
的含量。(3分)
26.(10分)
(1)混合气体中![]() 的体积分数60% (4分)
的体积分数60% (4分)
(2)设CO、![]() 在原混合物中的体积分数分别为x和y。
在原混合物中的体积分数分别为x和y。
![]()
2 1
x 0.5x
![]()
1 3
y 3y
![]() (2分)
(2分)
解得:24%≤x<40% (2分)
0<y≤16% (2分)
