高三下学期第一次月考化学试卷(I卷)
班级__________姓名__________
可能用到的相对原子质量:H+-1 O-16 N-14 Cl-35.5 C-12 S-32 P-31 Na-23
Mg-24 Al-27 Fe-56 Cu-64
一选择题(每小题有一个合理答案,15×3=45分)
1.用一定量Na2CO3溶液和足量的稀硫酸溶液来制取CO2,为了使反应速率减慢,又不减少生成CO2体积,(同温同压下)可向Na2CO3溶液中加入少量下列固体物质中的
A.BaCl2 B.KOH
C.Na2SO4 D.CH3COONa
2.金属锂不可能具有的性质是
A.锂在空气中燃烧可生成Li2O B.金属锂很软,可用小刀切割
C.金属锂比金属钠熔点高 D.金属锂可以保存在煤油或液体石蜡中
3.H2和Cl2的混合气共aL(标况),充分反应后,加入含bmolKOH的溶液,能使KOH全部转化为盐,则a,b的关系不可能是
A.b≥a/11.2 B.b<a/11.2 C.b>a/22.4 D.b<a/22.4
4.某盐X与酸Y反应后有刺激性气体Z生成,Z和烧碱反应后可以生成X,Z还可以被氧化成W,W和烧碱作用后的生成物中也有X,则X和Y分别是
A.硫化铝和盐酸 B.高锰酸钾和浓盐酸
C.亚硫酸钠和硫酸 D.氯化钠和浓硫酸
5.同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114g,则某气体的分子量为
A.28 B.60 C.32 D.44
6.往X盐溶液中通入过量氯气,无沉淀。再滴加氯化钡溶液和稀盐酸出现白色沉淀。则X盐可能是
A.亚硫酸钠 B.氯化钙 C.硝酸银 D.碳酸钠
7.下列离子方程式书写不正确的是
A.醋酸和纯碱溶液混合: 2CH3COOH+CO32-=CO2↑+H2O+2CH3COO-
B.苯酚钠溶液中通入少量CO2 : C6H5O-+CO2+H2O=C6H5OH+CO32-
C.小苏打溶液中加入少量石灰水: 2HCO3-+Ca2++2OH-=CaCO3+CO32-
D.氢氧化钡溶液中加入NaHSO4 : H++OH-=H2O
8.下列物质的晶体中,化学键类型相同,熔化时所克服的作用力类型也完全相同是
A.CO2和SiO2 B.NaCl和HCl C.(NH4)2CO3和CO(NH2)2 D.NaH和KCl
9.在NxOy+NH3![]() N2+H2O的氧化还原反应中,被还原的元素与被氧化的元素质量比是
N2+H2O的氧化还原反应中,被还原的元素与被氧化的元素质量比是
A.3x:2y B.x:3y C.5x:2y D.2x:3y
10.在某BaCl2溶液中通入SO2气体,未见沉淀生成;若先通入另一种气体,再通入SO2,则可以看到沉淀生成物。这种气体可能是
A.Cl2 B.NO C.HCl D.CO2
11.某溶液中含有HCO3-,SO32-,AlO2-,OH-等四种离子。若向其中加入Na2O2后,溶液中的离子浓度基本保持不变的是
A.HCO3- B.SO32- C.AlO2- D.OH-
12.下列离子方程式正确的确是
A.相同物质的量浓度的FeI2与溴水等体积混合
2Fe2++2I-+2Br2=2Fe3++I2+4Br-
B.Ba(OH)2溶液中加入过量NH4HSO4溶液:
Ba2++SO42-=BaSO4↓
C.漂白液溶液中通入适量的SO2
Ca2++2ClO-+SO2+H2O=CaSO4↓+2HClO
D.稀HNO3中加入过量铁粉 :
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
13.A、B两元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量,下列说法正确的是
A.元素B的非金属性一定强于A B.最易形成的离子化合物化学式为C2B
C.A、B两元素均可能位于VIA族 D.C、D两元素一定是碱金属元素
14.在下列各说法中都含有前后两个数值,其中前者小于后者的是
A.质量分数为10%的硫酸溶液与质量分数为20%的硫酸溶液的密度
B.卤素氢化物中,H—F键与H—Cl键的键能
C.正戊烷与新戊烷的沸点
D.钠原子与氯原子的半径
15. 在两个容积相同的容器中,一个盛有HCl气体,另一个盛有 H2和Cll2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A 原子数 B 密度 C质量 D 质子数
2003年下学期高三月考化学试卷(II卷)
班级________姓名______
二、填空(10×3=30分 )
16.老师在氢氧化钠溶液中滴加酚酞试液,溶液变红,再滴加氯水,直到红色刚好消失。由同学们讨论分析红色消失的可能原因;最后有两种意见:一种意见认为褪色是因为氯水的漂白作用,起漂白作用的物质是________(填化学式)。
另一种意见认为褪色是因为溶液PH值降低了,使PH降低的主要物质是__HCl____
请用一种最简单的方法判别哪种观点是正确的: _____________
17、氮化硼(BN)是一种新型的无机高分子材料,与石墨具有相似的结构和性质,常用作高温下的润滑剂。
(1)BN具有 形的平面网状结构。
(2)若氮化硼中含有n个硼原子,则最小的环有 个。
18、在有机溶剂里使nmolPCl5与nmolNH4Cl定量地发生完全反应,释放出4nmolHCl,同时得到一种白色晶体A。实验测得A的相对分子质量为348。
⑴生成A晶体的化学方程式________________________。
⑵分子结构测定表明:A分子具有六元环结构。同种元素在A分子中所处的环境等同且满足P五价,N三价,Cl一价,试写出A的结构式____________。
19、在氮化硅中添加氧化铝,用氧原子取代一部分氮,用铝原子取代一部分硅,通过常压烧结即成为新一代无机非金属材料叫氧氮化硅铝,即赛伦(Sialon),化学通式为:
Si6—XAlXOXNy(x:2~4)。则①判断赛伦属于_________晶体类型,并且有_______________等特性(至少写出三种)。
②化学通式里y值为____________(用含x的表达式或某一具体数值表示)。
 三、实验题(12分)
三、实验题(12分)
20.图示装置可用来制取和观察
Fe(OH)2在空气中被氧化时的颜色
变化.实验时必须使用铁屑和
6mol·L-1的硫酸,其他试剂
任选。填写下列空白:
(1))B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 .A中反应的离子方程式是 。
(2)实验开始时先应将活塞E (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式 。
四、推断题(8分)
21.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答:
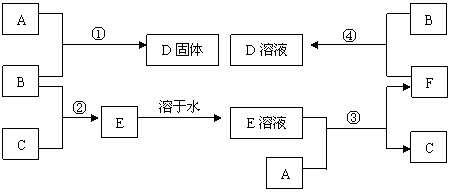
(1)A是_________、 B是________、 C是______(请填化学式)。
(2)反应4的化学方程式为:_______________________________
五计算填空(5分 )
22. 现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应。题中涉及的气体体积以标准状况计,填空时可以用带字母的分式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为 mol·L-1
答案
| 题号 | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 |
| 答案 | D | D | A | D | A | A | D | D |
| 题号 | 09 | 10 | 11 | 12 | 13 | 14 | 15 |
|
| 答案 | A | A | B | D | C | A | A |
|
16: HClO 再加点氢氧化钠
17 正六边形,n/2
18 3PCl5+3NH4Cl=P3N3Cl6+12HCl
19 原子,
21 A- Fe B-Cl2 c- H2