高三综合能力测试(化学)试题
9.当下列物质:①大理石 ②钟乳石 ③锅垢 ④贝壳 ⑤蛋壳,分别滴加醋酸时,会产生相同气体的
A.只有①② B.只有④⑤ C.只有①②③ D.是①②③④⑤
10.下列盛放试剂的方法正确的是
A.氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 B.汽油或煤油存放在带橡皮塞的棕色玻璃瓶中
C.碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D.氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
11.下列各组物理量中,都不随取水量的变化而变化的是
A.水的沸点;蒸发水所需热量 B.水的密度;水中通人足量CO2后溶液的pH
C.水的体积;电解水所消耗的电量 D.水的物质的量;水的摩尔质量
12.在一支25 mL的酸式滴定管中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
13.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A.半导体材料砷化镓 B.吸氢材料镧镍合金 C.透明陶瓷材料硒化锌 D.超导材料K3C60
14.已知天然气的主要成份CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应,前者大。下面是有关天然气的几种叙述:①天然气与煤、柴油相比是较清洁的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一。其中正确的
A.是①、②、③ B.只有① C.是①和② D.只有③
15.关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键 B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的 D.H2O是一种非常稳定的化合物,这是由于氢键所致
16.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(气)+B(气)=2C(气)
若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1;② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1;③ 2 s 时物质 A 的转化率为70% ; ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1。其中正确的是
A.①③ B. ①④ C. ②③ D. ③④
26.(25分)在啤酒生产过程中,发酵是重要环节。生产过程大致如下:将经过灭菌的麦芽汁充氧,接入啤酒酵母菌菌种后输入发酵罐。初期,酵母菌迅速繁殖,糖度下降,产生白色泡沫,溶解氧逐渐耗尽。随后,酵母菌繁殖速度迅速下降,糖度加速降低,酒精浓度逐渐上升,泡沫不断增多。当糖浓度下降一定程度后,结束发酵。最后分别输出有形物质和鲜啤酒。
根据上述过程,回答以下问题:
(4)请写出由麦芽糖→葡萄糖→酒精的反应方程式
(5)如果酵母菌消耗的糖(设为麦芽糖,其分子量为342)有98.5%(质量分数)形成了酒精(分子量为46.0)和其他发酵产物。设有500t麦芽汁,其中麦芽糖的质量分数为 8.00%,发酵后最多能生产酒糟浓度为3.20%(质量分数)的啤酒多少吨?
27.(9分)A、B、C、D、E 五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
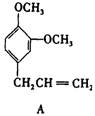
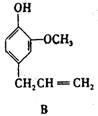
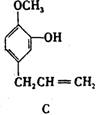
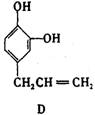
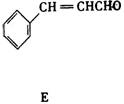
请回答下列问题:
(1)这五种化合物中,互为同分异构体的是 。
(2)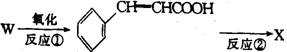
反应①采取了适当措施,使分子中烯键不起反应。以上反应式中的W是 A~E 中的某一化合物,则W是 。
X是D的同分异构体,X的结构简式是 。反应②属于 反应(填反应类型名称)。
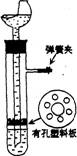 28.(30分)用图示的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
28.(30分)用图示的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
回答下面问题:
(1) 为什么关闭弹簧夹时试管中液面会下降?
(2) 这种制气装置在加入反应物前,怎样检查装置的气密性?
(3)从下面三个反应中选择一个可以用这种随制随停的制气装置制取的气体,填写下表中的空白。
① 大理石与盐酸反应制取二氧化碳② 黄铁矿与盐酸反应制取硫化氢③ 用二氧化锰催化分解过氧化氢制氧气
| 气体名称 | 收集方法 | 检验方法 |
(4)食盐跟浓硫酸反应制氯化氢不能用这种装置随制随停。试说明理由。
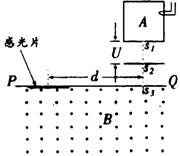 30.(24分)下图是测量带电粒子质量的仪器工作原理示意图。设法是某有机化合物的气态分子导入图中所示的容器A中,使它受到电子束轰击,失去一个电子变成正一价的分子离子。
30.(24分)下图是测量带电粒子质量的仪器工作原理示意图。设法是某有机化合物的气态分子导入图中所示的容器A中,使它受到电子束轰击,失去一个电子变成正一价的分子离子。
(2)根据分子离子的质量数M可用推测有机化合物的结构简式。若某种含C、H和卤素的化合物的M为48,写出其结构简式。
(3)现有某种含C、H和卤素的化合物,测得两个M值,分别为64和66。试说明原因,并写出它们的结构简式。
在推测有机化合物的结构时,可能用到的含量较多的同位素的质量数如下表:
| 元 素 | H | C | F | Cl | Br |
| 含量较多的同 位素的质量数 | 1 | 12 | 19 | 35,37 | 79,81 |
8.以下说法正确的是
A 纳米材料是指一种称为“纳米”的新物质制成的材料 B 绿色食品是指不含任何化学物质的食品
C 生物固氮是指植物通过叶面直接吸收空气中的氮气 D 光导纤维是以二氧化硅为主要原料制成的
9.沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是
A 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890kJ·mol-1
B CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890kJ·mol-1
C CH4(g)+4O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
D 1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-890kJ·mol-1
10.对已达化学平衡的下列反应 : 2X(g)+Y(g)![]() 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动 D 正、逆反应速率都增大,平衡向正反应方向移动
11.有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是
A 在25℃时,若溶液呈中性,则pH=7,AG=1 B 在25℃时,若溶液呈酸性,则pH<7,AG<0
C 在25℃时,岩溶液呈碱性,则pH>7,AG>0 D 在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
12.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中
A [HCOO-]>[Na+] B [HCOO-]<[Na+] C [HCOO-]=[Na+] D 无法确定[HCOO-]与[Na+]的关系
13.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前 10号元素中,满足上述关系的元素共有
A 1对 B 2对 C 3对 D 4对
14.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
 A
FeO B Fe2O3 C CuO D Cu2O
A
FeO B Fe2O3 C CuO D Cu2O
15.L–多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如右图:
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果。下列关于L–多巴酸碱性的叙述正确的是
A 既没有酸性,又没有碱性 B 既具有酸性,又具有碱性
C 只有酸性,没有碱性 D 只有碱性,没有酸性
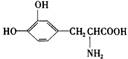
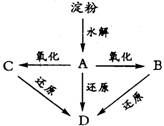 23.(8分)如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。已知,相关物质被氧化的难易次序是:
23.(8分)如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。已知,相关物质被氧化的难易次序是:
RCHO最易,R—CH2OH次之,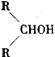 最难。
最难。
请在下列空格中填写A、B、C、D的结构简式。
A: B: C: D:
24.(12分)在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中 V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气中 V(CO)︰V(H2)= 。
(3)若剩余气体的体积为aL,则a的取值范围是 。
25.(8分)已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
28.(26分)磷是存在于自然界和生物体内的重要元素,回答下列与磷及其化合物有关的问题。
Ⅱ.(14分)(1)磷在自然界里主要以 的形式存在于矿石中。磷的单质有多种同素异形体,其中最常见的是有毒的 和无毒的 。
(2)磷在不充足的氯气中燃烧的化学方程式为: 。
而在过量的氯气中燃烧的化学方程式则是: 。
(3)磷(原子量为31)在空气中燃烧生成的氧化物通常可用作强干燥剂。制备100g这种干燥剂所消耗的空气的体积约为 L(在标准状况下)。
(4)有机磷农药“乐果”的结构简式是: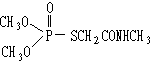
其中所含的双键有 个。
29.(37分)大气压强对许多物理实验和化学实验有着重要影响。
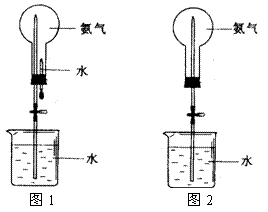 Ⅱ.(20分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
Ⅱ.(20分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
答:
8.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A ![]() He
B
He
B ![]() He
C
He
C ![]() He
D
He
D ![]() e
e
9.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
A CH4和NH3 B HCl、H2和CO C HCl和CO D HCl、CO和CO2
10.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+) B c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C c(Ba2+)>c(NO3-)>c(OH-)>c(NH4+) D c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
11.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A 3.0mol B 1.5mol C 1.0mol D 0.75mol
12.某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
13.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
14.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是
A 沉淀物的质量为5.6g B 沉淀物的质量为7.4g
C 饱和石灰水的质量大于98.2g D 饱和石灰水的质量小于98.2g
15.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
29.(7分)(1)1mol丙酮(CH3![]() COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
COOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是 。
(3)B的甲酯可以聚合,聚合物的结构简式是 。
30.(13分)根据图示填空
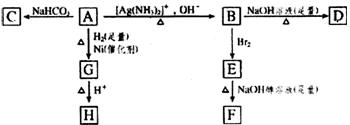
H是环状化合物C4H6O2 F的碳原子在一条直线上
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变为F,由E转变为F时发生两种反应,其反应类型分别是 。
(3)D的结构简式是 。
(4)1mol A与2mol H2反应生成1mol G,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是 。
31.(13分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
32.(7分)X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y和X的组成元素相同,Y的化学式是 ;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是 。
33.(22分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
参考答案
8 D 9 D 10 D 11 B 12 A 13 C 14 C 15 C 16 B
26.(25分)
(4)C12H22O11+H2O![]() 2C6H12O6 (2分)
2C6H12O6 (2分)
C6H12O6![]() 2C2H5OH+2CO2(2分)
2C2H5OH+2CO2(2分)
(5)C2H5OH的分子量为46.0
500t×8.00%×98.5%×![]() =662 t
(10分)
=662 t
(10分)
27.(9分)
(1)B和C(2分)
(2)E(2分) ![]() (3分)
(3分)
还原(或加成、加氢、催化加氢等)(2分)
28.(30分)
(1)关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。(6分)
(2)塞紧橡皮寨,夹紧弹簧夹后,从漏斗注人一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气。 (10分)
(3)(8分)
| 二氧化碳 | 向上排空气法 | 通入澄清石灰水使石灰水变浑浊 |
| 硫化氢 | 向上排空气法 | 有臭鸡蛋味(其它合理答案也给分) |
(只要回答出其中一种气体即给分)
(4)因为:此反应需要加热(4分) 食盐是粉末状(2分)
30.(2)CH3CH2F (3)从M的数值判断该化合物不可能含Br而只可能含Cl,又因为Cl存在两个含量较多同位素,即35Cl和37Cl,所以测得题设含C、H和卤素的某有机化合物有两个M值,其对应的分子结构简式为CH3CH235Cl M=64;CH3CH237Cl M=66
| 8.D | 9.C | 10.C | 11.D | 12.C | 13.B | 14.B | 15.B |
23.(12分)
A HOCH2(CHOH)4CHO B HOCH2(CHOH)4COOH C HOOC(CHO)4COOH D HOCH2(CHOH)4CH2OH
24.(12分) (1)5 5 (2)(a-10)︰(20-a) (3)10<a<20
25.(8分) (1)Cl(或氯) K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3![]() 2KCl+3O2↑28.(26分)
2KCl+3O2↑28.(26分)
28.Ⅱ.(14分)
(1)磷酸盐 白磷 红磷 (2)2P+3Cl2![]() 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2![]() 2PCl5
2PCl5
(3)188(空气中O2含量按21%计算)或197(空气中O2含量按1/5计算)
(4)2
29.(20分)
(1)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰
(3)打开止水夹,挤出胶头滴管中的水。
氢气极易溶解于水,致使烧瓶内气体压强迅速减小。
(4)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
| 8.B | 9.C | 10.B | 11.B | 12.C | 13.A | 14.D | 15.C |
29.(7分)
(1)![]()
(2)HOCH2CH2COOH![]() CH2=CHCOOH+H2O
CH2=CHCOOH+H2O
(3)![]()
30.(13分)
(1)碳碳双键,醛基、羧基
(2)消去反应 中和反应
(3)NaOOC-CH=CH-COONa
(4)OHC-CH=CH-COOH+2H2![]() HO-CH2-CH-CH2-COOH
HO-CH2-CH-CH2-COOH
(5)![]()
31.(13分)
(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案)
(3)2种 Li2CO3 MgCO3
(4)MgCO3,BeCO3,Na2CO3 1.05
32.(7分)
H2SO3,SO3,磷
33.(22分)
方法一 (1)稀H2SO4 铁屑
(2)煮沸
(3)避免生成的 Fe(OH)2沉淀接触O2
方法二 (1)稀 H2SO4 铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。