高三总复习专题:化学反应速率
一、选择题
1.下列四个数据都表示合成氨的反应速率,其中速率代表同一反应中的是
①V(N2)=0.2mol/L·min ②V(NH3)=0.9mol/L·min
③V(H2)=0.6mol/L·min ④V(H2)=0.0225mol/L·min
A.①② B.①③ C.③④ D.②④
2.工业上进行反应2SO2+O2![]() 2SO3+Q,使用催化剂的目的是
2SO3+Q,使用催化剂的目的是
A.扩大反应物的接触面 B.促使平衡向正反应方向移动
C.缩短达到平衡所需要的时间 D.提高SO2的转化率
3.在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)若最初加入的A.B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
4.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的
(A)碳酸钠固体 (B)乙酸钠固体 (C)硫酸钾固体 (D)硫酸铵固体
5.用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体,若要增大反应速率,可 (a)再加入30毫升3摩/升盐酸 (b)改用30毫升6摩/升盐酸 (c)改用3克粉末状大理石 (d)适当升高温度
( A )(a)(b)(d) ( B )(b)(c)(d) ( C )(a)(c)(d) ( D )(a)(b)(c)
6.在N2+3H2![]() 2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.75 mol/L·s,则所经历的时间是
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.75 mol/L·s,则所经历的时间是
(A)0.44s (B)1s (C)1.33s (D)1.2s
7.在相同温度下,下列化学反应速率最慢的是
(A)10mL 0.1mol/L Na2S2O3+10mL 0.1mol/L H2SO4
(B) 5mL 0.1mol/L Na2S2O3+5mL 0.1mol/L H2SO4
(C) 5mL 0.1mol/L Na2S2O3+5mL 0.05mol/L H2SO4
(D) 10mL 0.05mol/L Na2S2O3+10mL 0.05mol/L H2SO4
8.在其它条件不变时,设某物质在10℃时反应速率为3 mol/(L·s),每升高10℃,反应速率是原来的3倍,那么50℃时的反应速率是
(A)9 mol/(L·s) (B)27 mol/(L·s) (C)81 mol/(L·s) (D)243 mol/(L·s)
9.对于可逆反应A(气)+2B(气)![]() 2C(气)(正反应放热)的平衡体系,下列说法错误的是
2C(气)(正反应放热)的平衡体系,下列说法错误的是
(A)使用催化剂,v正、v逆都改变,变化的倍数相同
(B)降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数
(C)增大压强,正、逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数
(D)升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数
10.把下列4种X的溶液分别加入4个盛有10mL 2mol/L盐酸的烧杯中,均加水稀到50mL,此时X和盐酸和缓地进行反应。其中反应速率最大的是 (A)20mL 3mol/LX的溶液 (B)20mL 2mol/L的溶液
(C)10ml 4mol/LX的溶液 (D)10mL 2mol/L的溶液
11.下列体系加压后,对化学反应速率没有影响的是
(A)2SO2+O2![]() 2SO3
(B)CO+H2O(g)
2SO3
(B)CO+H2O(g) ![]() CO2+H2
CO2+H2
(C)CO2+H2O![]() H2CO3 (D)H++OH-
H2CO3 (D)H++OH-![]() H2O
H2O
12.设C+CO2
![]() 2CO(正反应吸热),反应速度为v 1;N2+3H2
2CO(正反应吸热),反应速度为v 1;N2+3H2![]() 2NH3(正反应放热),反应速度为v 2。当温度升高时,v 1和v 2的变化情况为\
2NH3(正反应放热),反应速度为v 2。当温度升高时,v 1和v 2的变化情况为\
(A)都增大 (B)都减小 (C)v 1增大v 2减小 (D)v 1减小v 2增大
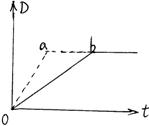
![]() 13.已知反应3A(g)+B(g)
C(s)+4D(g);△H<0,下图中a、b表示在一定条件下,D的体积分数随时间t的变化情况。若使曲线b变为曲线a,可采取的措施是
A、增大B的浓度 B、升温
13.已知反应3A(g)+B(g)
C(s)+4D(g);△H<0,下图中a、b表示在一定条件下,D的体积分数随时间t的变化情况。若使曲线b变为曲线a,可采取的措施是
A、增大B的浓度 B、升温
C、加压使容器容积缩小 D、加入催化剂
![]()
 14.在一定条件下将X和Y两种气体按不同比例放入密闭容器中反应达到平衡后,测得X和Y的转化率与起始时两物质的物质的量之比n(X)/ n(Y)的关系如右图所示,则X和Y的反应方程式可表示为
14.在一定条件下将X和Y两种气体按不同比例放入密闭容器中反应达到平衡后,测得X和Y的转化率与起始时两物质的物质的量之比n(X)/ n(Y)的关系如右图所示,则X和Y的反应方程式可表示为
![]()
![]()
![]()
![]() A、3X+Y Z B、2X+Y Z C、X+3Y Z D、3X+Y 2Z
A、3X+Y Z B、2X+Y Z C、X+3Y Z D、3X+Y 2Z
![]() 15.右图表示A(g)+B(s) C(s)+D(g)(正反应为放热反应)
15.右图表示A(g)+B(s) C(s)+D(g)(正反应为放热反应)
的正逆反应速率(V)与时间(t)的变化关系。t1时改变的条件可能是
①加入A ②加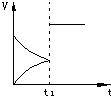 入催化剂 ③加压 ④升温 ⑤减少C
入催化剂 ③加压 ④升温 ⑤减少C
A.①② B.③④ C.②③ D.④⑤
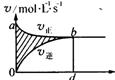
![]() 16.在容积固定为4L的密闭的容器中,进行可逆反应:X(g)+2Y(g) 2Z(g)达到平衡时在此过程中,以Y的浓度改变表示的反应速率V正,V逆与时间t的关系如右图,则图中阴影部分面积表示( )
16.在容积固定为4L的密闭的容器中,进行可逆反应:X(g)+2Y(g) 2Z(g)达到平衡时在此过程中,以Y的浓度改变表示的反应速率V正,V逆与时间t的关系如右图,则图中阴影部分面积表示( )
A X的浓度的减少B Y的物质的量的减少C Z的浓度增加 D X的物质的量的减少
17.下列措施,一定不能加快化学反应速率的是
A.增大压强 B.升高温度 C.加催化剂 D.增大体积
18.下列措施肯定能使化学反应速率增大的是
A.增大反应物的量 B.增大压强 C.升高温度 D.使用催化剂
19、20℃时将0.1mol·L-1Na2S2O3溶液10mL和0.1mol·L-1的H2SO4溶液10mL混合,2min后溶液中明显出现浑浊,已知温度每升高10℃,化学反应速率增加到原来的2倍,那么50℃时,同样的反应要同样看到浑浊,需要的时间是
A、40s B、15s C、48s D、20s
20.反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
21.Fe3+和I-在水溶液中的反应如下:2I![]() +2Fe
+2Fe![]()
![]() 2Fe
2Fe![]() +I2(水溶液)。
+I2(水溶液)。
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后 ,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、 向左、不)。
(2)上述反应的正向反应速率和I![]() 、Fe
、Fe![]() 的浓度关系为:V=K[C(I-)]m[C (Fe
的浓度关系为:V=K[C(I-)]m[C (Fe![]() )]n(K为常数)
)]n(K为常数)
| C (I | C | V(mol/L·S) | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
通过所给的数据计算得知:在V=K[C(I-)]m[C(Fe3+)]n 中mn的值为 。
A.m=1 n=1 B.m=1 n=2
C.m=2 n=1 D.m=2 n=2
I-浓度对反应速率的影响 Fe3+浓度对反应速率的影响。(选填:大于、小于、等于)
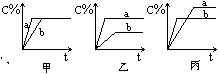 22.(6分)现有可逆反应A(气)+B(气)
22.(6分)现有可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则_ __曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_ __ __热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则__ __曲线是表示压强较大的情况。
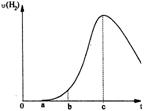 23.把在空气中久置的铝片5.0 g投入盛有 500 Ml0.5 mol·L-1硫酸溶
23.把在空气中久置的铝片5.0 g投入盛有 500 Ml0.5 mol·L-1硫酸溶
液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的
坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因_________________ __,
有关的化学方程式为___________________;
(2)曲线由a→b段产生氢气的速率较慢的原因_____________________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
高三总复习专题:化学反应速率答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | C | C | B | B | D | D | D | C | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
| D | A | CD | AD | C | C | D | CD | B |
|
20、④>②=③>①
21、(1)K=c(Fe2+)2·c(I2)/c(I-)2·c(Fe3+)2 ,向右
(2)C, 大于
22、(1)a (2)吸 (3)b
23、 (1)铝表面有氧化膜,Al2O3+3H2SO4=Al2(SO4)3+3H2O
(2 ) 铝表面有氧化膜还没有完全溶解,铝与硫酸的接触面积较小
(3)因反应放热,溶液温度升高
(4)随着反应进行,氢离子浓度减小