高三总复习专题:镁、铝
一、选择题
1.镁粉在焰火、闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气体的是(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2
A.(1)(2) B.(2)(3) C.(3)(4) D.(4)(5)
2.由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是
A、锌 B、铁 C、铝 D、镁
3.有甲、乙、丙、丁四种金属,将甲、乙用导线相连放人稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断铜是
A 甲 B 乙 C 丙 D 丁
4.镁、铝都是较活泼的金属,下列描述正确的是
A.镁的硬度比铝稍大,熔沸点都比铝高 B.镁铝都能跟稀盐酸、稀硫酸、强碱反应
C.镁在点燃条件下可以跟二氧化碳起反应,铝在一定条件下可以跟氧化铁发生反应
D.铝热剂是镁条、铝粉和氧化铁的混合物
5.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是
A.熔融的MgO不导电 B.MgO分子间作用力很大 C.MgO熔点高 D.MgO属原子晶体
6.将物质的量都为amol的Na和Al一同放入mg足量水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为
A.![]() mol/L
B.
mol/L
B.![]() mol/L
C.
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
7.在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图,则下列说法正确的是
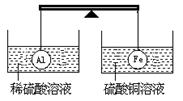 A.铝球一定是空心的
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
8.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A.Fe3+、Cl-、Na+、SO42- B.Al3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3- D.AlO2-、CO32-、K+、Na+
9.bL硫酸铝溶液中含有agAl3+,则溶液中SO2-4 的物质的量的浓度为
 A.3a/2b mol/L
B.a/27b mol/L
A.3a/2b mol/L
B.a/27b mol/L
C.a/18b mol/L D.2a/81b mol/L
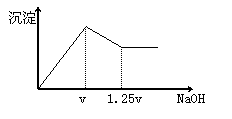
10.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液 ,
得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中
C(Cl¯)与C(SO42-)之比为
A.1∶1 B.2∶3 C.3∶2 D.2∶1
11.向下列溶液中加入氨水直至过量,最终能得到无色澄清溶液的是 A Al2(SO4)3溶液 B AgNO3溶液 C CuSO4溶液 D MgCl2溶液
12.只用一种试剂就可以鉴别NaCl、Na2S、NaAlO2、NaHCO3四种无色溶液、此试剂可能是
A、AlCl3溶液 B、BaCl2溶液 C、盐酸 D、NaOH溶液
13.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大
A.AlCl3 B.HCl C.CO2 D.NaHSO4
14.一瓶失去标签的盐溶液,若向其中分别加入少量烧碱溶液,纯碱溶液和硫化钠溶液,结果都生成沉淀,而且沉淀是同种物质,则该盐是
A、Al2(SO4)3 B、AgNO3 C、MgCl2 D、CuSO4
15.既能跟明矾溶液反应,又能跟适量NH4HSO4溶液反应生成白色沉淀的是
A. FeCl3溶液 B.NaHCO3溶液 C.KAlO2溶液 D.Ba(OH)2溶液
16.现有20mLMgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L、[Cl—]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4mol/L NaOH溶液
A.140mL B.120mL C.100mL D.80mL
17.下列操作中,始终不能观察到白色沉淀的是
A.将少量氨水滴入氯化铝溶液中 B.将少量氢氧化钠滴入氯化铝溶液中
C.将少量氯化铝溶液滴入氢氧化钠溶液中 D.将少量偏铝酸钠溶液滴入氢氧化钠溶液中
18.某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成.该溶液加入NaOH溶液出现白色沉淀;加入稀H2SO4也出现白色沉淀,并放出气体.据此分析,下述组合判断正确的①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有NaHCO3或Na2CO3⑤肯定没有MgCl2
A.①②③ B.①③ C.②④ D.①③⑤
19.固体物质A与稀硫酸反应生成溶液C,C与氢氧化钠溶液反应生成沉淀B,B加热又转变为A,则A可能是A.BaO B.CuO C.Fe2O3 D.Na2O
20.当向下列各组溶液中分别通入CO2后,可能产生白色沉淀的是①澄清石灰水 ②MgCl2和BaCl2混合溶液 ③NaAlO2溶液 ④CaCl2和氨水的混合溶液 ⑤Ca(HCO3)2溶液
A.①③④ B.②③④ C.①③ D.②④⑤
21.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag,该实验使用的仪器名称为________.
(2)将样品溶解于足量稀盐酸中,过滤,滤液中主要含有_______________,滤渣中含有________________.该溶解、过滤实验中使用的仪器有 ________ _。
(3)滤液中加入过量NaOH溶液,过滤.写出该实验有关的离子方程式______________________________________________________。
(4)上述滤液通入足量的CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止, 冷却后称重,质量为bg.有关化学方程式:计算该样品中铝的质量分数为_________________________________________________.
(5) (A)若实验3中,NaOH量不足,则测定结果偏______(高、低、不影响)
(B)若实验4中沉淀没有洗涤,则结果偏______(高、低、不影响)
22.把一支表面被氧化成10.2g氧化铝的铝条A,放入1L1.5mol/L热氢氧化钠溶液中,过一段时间后取出铝条,溶液质量增加了12.6g,此时的溶液称为甲溶液,体积仍为1L。再把另一支表面也被氧化的一定量的铝条B,放入1L 0.9mol/L硫酸溶液中,过一会儿取出,其质量减小了25.8g,溶液的质量增加了25.2g,此时的溶液称为乙溶液,体积仍为1L。回答下列问题:
(1)甲溶液的溶质是__________ ______(写化学式),其物质的量是_____________。
(2)乙溶液的溶质是___________ ____(写化学式),其物质的量是____ ______。
(3)将甲、乙两溶液反应,若使滴加的量最少,而产生的沉淀最多,应将___溶液___L滴加到____溶液(用“甲”或“乙”填写),产生的沉淀最多是_____g。
23.在水溶液中铝元素可以__________或__________两种离子存在,若以__________离子存在水pH值必小于7,若以___________离子存在于水溶液中,pH值必大于7,将分别含有上述离子的两种溶液混和时,析出白色沉淀物,发生反应的离子方程式是__________。
24.有阳离子Al3+、Na+、Mg2+、Ba2+和阴离子CO32—、AlO2—、Cl—、OH—相互形成化合物A、B、C、D、E。试根据其主要性质填写下列分子式。并按要求写出有关离子方程式。
(1)A可由明矾和氨水反应而制得。A________,离子方程式______________。
(2)B微溶于水,可溶于稀H2 SO4,而生成无色澄清溶液,且放出气体。
B___________,离子方程式___________________。
(3)C的水溶液的PH值大于7,通入过量CO2气体可产生沉淀。
C____________,离子方程式___________________。
(4)D的水溶液的PH值小于7,与C溶液混和只产生一种沉淀。
D____________,离子方程式___________________。
(5)E的水溶液的PH值大于7,与D溶液混和产生白色沉淀和气体。
E____________,离子方程式___________________。
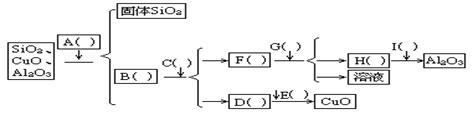
25、按下列流程,分离SiO2、Al2O3、CuO混合物粉末,在A—I括号内填以适当的内容(必要的操作或试剂名称及所需试剂是否过量).
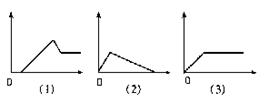 26.下图分别表示向I中的溶液逐渐加入(或通入)Ⅱ中的试剂的物质的量(横坐标)与产生沉淀的量(纵坐标)之间的关系。
26.下图分别表示向I中的溶液逐渐加入(或通入)Ⅱ中的试剂的物质的量(横坐标)与产生沉淀的量(纵坐标)之间的关系。
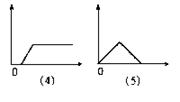 |
Ⅰ溶液:A饱和和石灰水B 氯化铝溶液C 偏铝酸钠溶液D 酸化的氯化铝、氯化镁溶液E 氢氧化钠溶液
Ⅱ溶液:a氢氧化钠溶液 b稀盐酸 c氨水 d二氧化碳 e氯化铝溶液
试将图号对应的溶液标号填入下表(注意:答案不能重复)
| 图号 | (1) | (2) | (3) | (4) | (5) | |
| 答 | Ⅰ | |||||
| 案 | Ⅱ | |||||
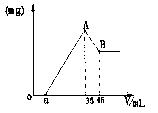 27.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
27.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
放入盛有100mL某浓度的硫酸溶液的烧杯中,充分反应后过
滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质
量m与加入NaOH溶液的体积V的关系如右图所示。请填
空回答:(1)H2SO4溶液的物质的量浓度为_________.
(2)若a=2.3mL,用于沉淀Fe3+消耗NaOH溶液的体积是________mL。铝土矿各组成成分的质量分数:
Al2O3%________,Fe2O3%________,SiO2%_________.
(3)a值的范围应是__________,在这个范围内,a值越大,______
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | C | C | C | B | BD | B | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| BC | AC | A | A | CD | D | D | A | BC | A |
21、(1)天平
(2)Al3+ Mg2+ Cl-,Cu Si .烧杯、玻璃棒、铁架台、漏斗
(3)Mg2++2OH-=Mg(OH)2↓ Al3++4OH-=AlO2-+2H2O
(4)9b/17a
(5)高,高
22.(1)NaAlO2,0.3mol;NaOH,1.2mol
(2)Al2(SO4)3,0.3mol
(3)乙,0.83L,甲,62.4 g
23.Al3+,AlO2—,Al3+,AlO2—,Al3++3AlO2—+6H2O==4Al(OH)3↓
24.(1)A:Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(2)B:MgCO3 MgCO3+2H+===Mg2++CO2↑+H2O
(3)C:NaAlO2 2AlO2 —+CO2+3H2O==2Al(OH)3↓+3CO32—
(4)D:AlCl3 Al3++3AlO2—+6H2O==4Al(OH)3↓
(5)E:Na2CO3 3CO32—+2Al3++3H2O==2Al(OH)3↓+3CO2↑
25.A.盐酸,B:氯化铜、氯化铝,C:过量氢氧化钠,D:氢氧化铜,E:加热
F:偏铝酸钠,G:二氧化碳,H:氢氧化铝,I:加热
26.
| D | C | B | E | A |
| a | b | c | e | D |
27.(1)1.75mol/L (2)2.7,85%,12%,3% (3)1.625<a<5, Fe2O3