高三化学元素及其化合物测验卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。第I卷1至3页,第II卷4至8页。共150分。考试时间120分钟。
第I卷(选择题,共60分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、考生号、座位号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试卷上。
可能用到的原子量:H:1 O:16 Al:27 K:39 Cl:35.5 Fe:56 S:32 Na:23 Cu:64
一、选择题(本题包括7小题,每小题4分,共28分。每小题只有一个选项符合题意。)
1.食品卫生与身体健康密切相关。下列做法会导致食品对人体有害的是
①在沥青公路上翻晒粮食
②香肠中加过量亚硝酸纳以保持肉类新鲜
③用生活用煤直接烧烤烤鸡、鸭
④用“瘦肉精”(一种含激素的饲料)喂饲生猪
⑤用小苏打做发酵粉做面包
⑥用福尔马林保鲜鱼肉等食品
A.①②③④⑥ B.①②③④⑤⑥ C.①②③④⑤ D.①②③④
2.向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是
A.Na2SiO3 B.BaCl2 C.FeCl3 D.NaAlO2
3.盛放在敞口容器中的下列溶液,久置后溶液中原溶质的浓度会变大的是
A.浓硫酸 B.浓氢氧化钠 C.氯水 D.氯化钠
4.甲、乙两烧瓶中各盛有100mL3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲 : 乙=2 : 3(相同状况),则加入铝粉的质量为
A.2.7克 B.3.6克 C.5.04克 D.4.05克
5.下列各组物质中,都是由分子构成的一组化合物是
A.CO2、NO、SiO2 B.CH4、H2SO4、C6H5OH
C.HD、H2O2、H2O D.NH3、HCI、NH4CI
6.将固体X投入足量液体Y中,能生成白色沉淀并放出一种无色气体,该气体不溶于水并能燃烧,X和Y可能分别是
A.金属钠和硫酸铜溶液 B.碳化钙和纯碱液
C.铝粉和烧碱溶液 D.锌和稀硫酸
7.宇宙飞船是用N2H4(联氨)与N2O4作推力能源,其未配平的反应式为
N2H4+N2O4→N2+H2O,下列说法正确的是
A.N2既是氧化产物又是还原产物 B.氧化产物与还原产物物质的量之比为1 : 2
C.联氨是氧化剂 D.氧化剂与还原剂物质的量之比为2 : 1
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选择符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确给2分;选两个且正确给4分,但只要选错一个,该小题就为0分)
8.下列各组溶液,不用其它试就可以将它们区分开的是
A.KOH、K2CO3、MgSO4、KHSO4 B.NaNO3、HCl、NH4Cl、KOH
C.BaCl2、CaCl2、Na2SO4、AgNO3 D.H2SO4、Al2(SO4)3、NaCl、KOH
9.下列各面组物质的溶液逐滴互滴,前一种溶液逐滴滴入后一种溶液中,与后一种溶液逐滴滴入前一种溶液中产生的现象相同的是
①Ba(OH)2和稀H3PO4 ②HNO3和NaAlO2 ③NaOH和AlCl3 ④Ca(HCO3)2和Ba(OH)2 ⑤Na2CO3和HCl ⑥AgNO3和NH3·H2O ⑦NaHCO3和HCl
A.①⑤ B.②④ C.⑤⑦ D.④⑦
10.在含有AlO2-的溶液中,下列离子可以大量共存的是
A.CO32-、OH-、Cl-、NH4+ B.Cl-、HSO3-、Na+、K+
C.H+、CI-、NO3-、Na+ D.CO32-、NO3-、S2-、K+
11.将40mL1.5mol·L-1的CuSO4溶液与30mL 3 mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中[Cu2+]或[OH-]都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
12.下列离子方程式正确的是
A.硫酸铜溶液中通入过量的硫化氢:Cu2++H2S=CuS↓+2H+
B.将少量Ba(OH)2溶液滴入NaHSO4溶液中:Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.金属铁溶于稀硫酸中:2Fe+6H+=2F3++3H2↑
D.NO2气体通入水中:3NO2+H2O=2H++2NO3-+NO
13.钠在干燥的空气中形成的氧化物0.7g,溶于水后,可被0.25mol·L-1的盐酸80mL恰好中和,则钠的氧化物的成分是
A.Na2O B.Na2O与Na2O2 C.Na2O2 D.Na2O与NaO2
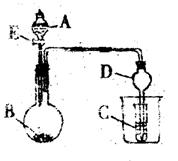
14.如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是
|
C中盛C6H5ONa溶液,则C中溶液变浑浊
B.若A为食盐水,B为电石,C中盛酸性
KMnO4溶液,则C中溶液紫色褪去
C.若A为浓氨水,B为生石灰,C中盛
AgNO3溶液,则C中无现象
D.实验中仪器D可起到防止倒吸的作用
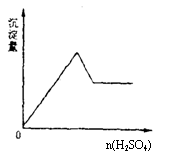 15.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与加入硫酸的关系如图所示,则原溶液可能是
15.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与加入硫酸的关系如图所示,则原溶液可能是
A.NaAlO2与Na2S2O3的混合溶液
B.Na2SiO3与Na2CO3的混合溶液
C.AlCl3与CuSO4的混合溶液
D.Na2SO3与Na2S的混合溶液
第II卷(非选择题,共90分)
注意事项:第II卷共5页,用钢笔或圆珠笔将答案直接写在试卷上。
| 题号 | 三 | 四 | 五 | 六 | 总分 |
| 分数 |
| 得分 | 评卷人 | |
| 三、(本题包括3小题,共25分) |
16.(5分)下列有关实验的叙述,不正确的是(填标号)
A.用天平称取固体烧碱时,将NaOH固体放在垫有干净滤纸的托盘上
B.用浓氨水洗涤做过银镜反应的试管
C.将铜丝伸入热的硫蒸气中可得到CuS
D.铜片跟稀硝酸共热产生的气体必须用排水法收集
E.久盛石灰水的试剂瓶用硫酸溶液洗涤
F.浓硫酸不慎溅在皮肤上,立即用稀NaOH溶液冲洗
17.(8分)酸雨是天空降水呈酸性(pH小于5.6)的统称,个别地方竟低于2.1(食醋的pH=3)。形成酸雨的原因是大气中的SO2和氮氧化物。主要来源是煤和石油的燃烧,全世界每年有1.5亿吨SO2的排放量。
(1)SO2可在空气中受光照被氧化,最终与雨水形成酸雨。试写出这两个化学反应方程式: ; 。
(2)汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物,全世界每年排放量约5×107kg。NO2溶于水生成 酸。
(3)酸雨可导致的危害有 (错选倒扣分)
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.恶化人类环境
(4)为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行
,对废气中的氮氧化物进行 。
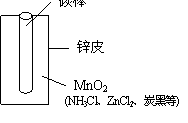 18.(12分)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
18.(12分)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
(1)干电池的基本构造和工作原理
右图为干电池的基本构造图。干电池工作时负极上
的电极反应式是 ,MnO2的作用是除去正极上的产物H2,该反应方程式为2MnO2+H2=H2O+Mn2O3。
(2)锌皮和碳棒的回收
用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤:
。
②设计简要的实验证明所得晶体中含有NH![]() 。
。
实验步骤:
。
实验现象: 。
有关的离子方程式: 。
③用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开?
。
(4)最后剩余的黑色残渣的主要成份是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器有 。
| 得分 | 评卷人 | |
| 四、(本题包括3小题,共22分) |
19.(6分)多硫化物S![]() (X的数值在2~6之间)在碱性溶液中被BrO
(X的数值在2~6之间)在碱性溶液中被BrO![]() 氧化为SO
氧化为SO![]() ,而BrO
,而BrO![]() 被还原为Br-,在反应中消耗BrO
被还原为Br-,在反应中消耗BrO![]() 和OH-的物质的量之比为2 : 3,则
和OH-的物质的量之比为2 : 3,则
(1)X的值为 ,
(2)反应的离子方程式 。
(3)此反应的还原剂与氧化剂物质的量之比是 。
20.(8分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是A ,B ,C ,D 。
(2)这四种元素单质的熔点由高到低的顺序是 。
(3)C的固态氧化物晶体类型是 晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式
。
21.(8分)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)
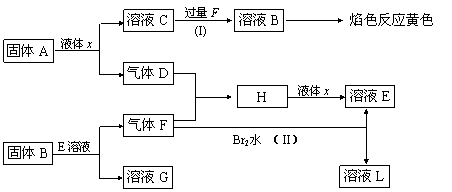 |
请回答:
(1)固体A是(写化学式) 。
(2)反应(I)的化学方程式 。
(3)反应(II)的化学方程式 。
| 得分 | 评卷人 | |
| 五、(本题包括3小题,共23分) |
22.(6分)某无色透明溶液能与铝反应放出H2,该溶液中可能含有:H+、K+、Mg2+、
Cl-、OH-、NO3、CO![]() 等,试推断:
等,试推断:
第一种情况:一定有 离子,可能有 离子;
第二种情况:一定有 离子,可能有 离子。
23.(8分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含量的总质量相同。请填空:
(1)锗和铋的元素符号分别是 和 。
(2)BGO晶体的化学式是 。
(3)BGO晶体中所含铋氧化物的化学式是 。
24.(8分)铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题
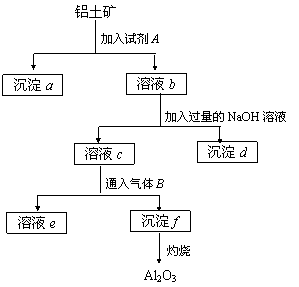 |
(1)沉淀物的化学式分别是:a ; d ; f 。
(2)溶液b中所含的金属阳离子是 ;溶液c中所含的酸根阴离子是 。
(3)加入的试剂A是 ,通入的气体B是 ,能否将B换成A?其理由是
。
| 得分 | 评卷人 | |
| 六、(本题包括2小题,共20分) |
25.(8分)将一定质量的NaHCO3和Na2CO3的混合溶液,加入过量的1mol·L-1Ba(OH)2溶液120m L使CO32-沉淀完全。过滤后在滤液中加入2-3滴酚酞指示剂,再滴入1mol·L-1的硫酸95m L时刚好红色褪去。
求:(1)原混合物中NaHCO3的质量。
(2)若要求出NaCO3的质量,结合题给数据,还需已知下列哪个数据
(填选项、答案可能不只一个。)
(A)NaHCO3和Na2CO3混合物的质量(B)生成BaCO3的质量(C)生成BaSO4的质量
26. (12分)向30.0mL硫酸铜溶液中加入过量铝粉,待充分反应后,再向其中加入2.00mol·L-1烧碱溶液至沉淀不再减少,消耗烧碱溶液210mL,且收集到气体0.672(标准状况下)。据此计算:
(1)加入铝粉的质量。
(2)原硫酸铜溶液的物质的量浓度。
高三元素及化合物参考答案及评分标准
第I卷
一、(本题包括7小题,每小题4分,共28分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | A | D | D | D | B | B | A |
二(本题包括8小题,每小题4分,共32分)
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | AD | D | D | D | AD | B | C | A |
第II卷
三、(本题包括3小题,共25分)
![]() 16.(5分)A、B、C、E、F(每答对1个得1分)
16.(5分)A、B、C、E、F(每答对1个得1分)
17.(1) 2SO2+O2 2SO3 ;SO3+H2O=H2SO4 (2分)
(2)硝(1分) (3)ABD (2分) (4)脱硫,碱液吸收(2分)
18.(12分)(1)Zn-2e=Zn2+ (2分)
(3)①向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热,蒸发结晶 (2分)
②实验步骤:取少量晶体溶于蒸馏水配成溶液。取少许溶液,加入少量NaOh溶液后加热,将湿润的红色石蕊试纸放在试管口(2分)
![]() 实验现象:试纸变蓝(1分)
实验现象:试纸变蓝(1分)
有关离子方程式:NH4+ +OH- NH3↑+H2O (1分)
③加热法 (2分)
④坩埚、酒精灯(玻璃棒、三脚架)等(2分)
四、(本题包括3小题,共22分)
19.(6分)5(2分)
3S25-+16BrO3-+24OH-=15SO42-+16Br-+12H2O (2分) Na2S5 (2分)
20.(8分)(1)碳、氧、硅、钠 (4分)
(2)C>Si>Na>O (1分)
![]() (3)原子(1分)
(3)原子(1分)
(4)Na2CO3+SiO2 Na2SiO3+CO2↑ (2分)
21.(8分)(1)Na2O2 (2分)
(2)NaOH+SO2=NaHSO3 (3分)
(3)SO2+Br2+2H2O=H2SO4+2HBr (3分)
五、(本题包括3小题,共23分)
22.(6分)一定有 H+、Cl- 离子,可能含有 K+、Mg2+ (3分)
一定有 OH-、K+ 离子,可能有 ClCO32-、NO3- 离子。(3分)
23(8分)(1)Ge Bi (2分)
(2)Bi4Ge3O12[或2Bi2O3·3GeO4、3GeO2、Bi4(GeO4)3] (3分)
(3)Bi2O3 (2分)
24(9分)(1)SiO2、Fe(OH)3、Al(OH)3 (3分)
(2)Fe3+ Al3+,AlO2- (2分)
(3)HCl,CO2 (2分)
不行,AL(OH)3是两性氢氧化物能溶于强酸。
六、(本题包括2小题,共20分)
25.(8分)(1)设NaHCO3的物质的量为x,由方程:
2NaHCO3+Ba(OH)2=2H2O+BaCO3↓+Na2CO3
Na2CO3+Ba(OH)2=BaCO3↓+2NaOH
2NaOH+H2SO4=Na2SO4+2H2O
x+0.095l×2×1mol·1-1=1mol·1-1×2×![]()
∴x=o.05 (mol) (3分)
∵NaHCO3的质量:84g/mol×0.05mol=4.2g (2分)
答:原混合物中NaHCO3的质量为4.2g
(2)A或B或C 1分×3=3分
26.(12分)(1)3.24 (2)5
(1)Na2S2O3+H2SO4+NaSO4+SO2↑+S↓+H2O
Na2S+H2SO4=Na2SO4+H2S↑
2H2S+SO2=3S↓+2H2O (6分)
(2)336mL气体是H2S。因为溶液中有H2S,故SO2完全反应 (2分)
(3)设原溶液含Na2S2O3物质的量为X,Na2S的物质的量为Y,则X+3X=
![]() ,解得X=0.0250 mol (2分)
,解得X=0.0250 mol (2分)
Y=2X+![]() +0.100mol·L-1×0.100L=0.0750 mol
(3分)
+0.100mol·L-1×0.100L=0.0750 mol
(3分)
答:略