高三化学质量检测卷4
本试卷分第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分,共150分。考试时间120分种。
第Ⅰ卷(选择题 共74分)
可能用到的相对原子质量:H—1 C—2 O—16 Na—23 S—32 Cl—35.5 K—39
Ca—40 Fe—56 Ba—137
一、选择题(本题包括8小题,共24分。每小题只有一个选项符合题意。)
1.下列选项中,不属于空气质量日报指标的是 ( )
A.二氧化碳 B.氮氧化合物 C.二氧化硫 D.可吸入颗粒物
2.1H、2H、3H中,中子数比质子数多的是 ( )
A.1H B.2H C.3H D.1H和2H
3.1828年,德国化学家武勒(F·WOhler)冲破了生命力学术的束缚,在实验室里将无机
物氰酸铵(NH4CNO)溶液蒸发,得到了有机物尿素[CO(NH2)2]。下列说法中,不正确的
是 ( )
A.氰酸铵属于铵盐 B.氰酸铵与尿素互为同分异构体
C.有机和不一定要从生命体内获得 D.氰铵转变为尿素的过程为物理变化
4.夏天,鸡没有汗腺只能依赖“喘息”调节体温。鸡过度的呼出CO2,使下列平衡向左移
动导致蛋壳变薄,使农场主和超市经营者蒙受经济损失。 ( )
![]()
![]() CO2(g) CO2(aq),CO2(aq)+H2O H2CO3(aq)
CO2(g) CO2(aq),CO2(aq)+H2O H2CO3(aq)
![]()
![]() H2CO3(aq) H+(aq)+HCO3-(aq), HCO3-(aq) H+(aq)+CO32-(aq)
H2CO3(aq) H+(aq)+HCO3-(aq), HCO3-(aq) H+(aq)+CO32-(aq)
![]() Ca+(aq)+CO32-(aq) CaCO3(s)(蛋壳)
Ca+(aq)+CO32-(aq) CaCO3(s)(蛋壳)
澳大利亚学者研究发现,夏季给鸡喂食下列某种饮料会使蛋壳变厚,这种饮料是( )
A.淡盐水 B.碳酸水 C.蔗糖 D.澄清石灰水
|
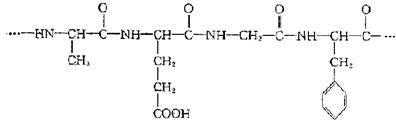
这种高分子化合物可能是 ( )
A.纤维素 B.淀粉 C.蛋白质 D.油脂
6.下列离子方程式中,正确的是 ( )
A.醋酸与小苏打溶液反应:H++HCO3-=CO2↑+H2O
B.硫氢化钠的水解:HS-+H2O=H3O++S2-
C.铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+
|
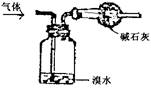
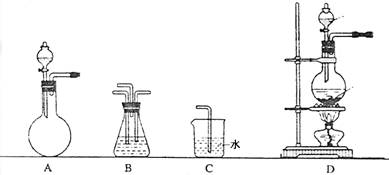
7.下列四种气体(括号内是混有的少量杂质),其中可用右图所
示装置进行净化和干燥的气体组是 ( )
A.SO2(HCl) B.C2H6(C2H4) C.CO2(SO2) D.NH3(N2)
8.洪涝地区的灾民欲钭江河水转化为可饮用水,下列处理过程较
合理的是 ( )
①化学沉降(用明矾) ②消毒杀菌(用漂白粉) ③自然沉降 ④加热煮沸
A.①②③④ B.③①②④ C.③①④② D.①③④②
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
9.下列有关物质性质判断正确的是 ( )
A.沸点:HF>HCl B.水中溶解性:C2H5Br>C2H5OH
C.熔点:金刚石>C60 D.密度:氨水>水
10.下列分子属于非极性分子的是 ( )
A.CH2Cl2 B.CO2 C.H2O D.C2H2
11.下列说法正确的是 ( )
A.用结晶法去硝酸钾中混有的少量氯化钠
B.用湿润的pH试纸测定溶液的pH
C.用点燃的方法除去二氧化碳中混有的少量一氧化碳
D.在氢氧化铁胶体中加入过量的盐酸最终会产生沉淀
12.设NA为阿伏加德罗常数值,下列说法正确的是 ( )
A.常温常压下,0.1NA个H2O分子的质量为1.8g
B.7.1gCl2变为氯离子时,得到的电子数为0.1NA
C.20℃、1.01×105Pa时,11.2LH2所含原子数为NA个
|
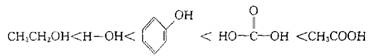
13.下列物质酸性的强弱顺序为:
|
|
A.CH3CH2NH2 B. C. D.CH3CONH2
14.H2C=CHOH不稳定,在常温下为液体,很容易转化成稳定的CH3CHO。然而,2002年的美国《科学》杂志报道:外太空的某一个星球的大气层含有大量的H2C=CHOH。请预测该星球的温度是 ( )
A.较低温度 B.较高温度
C.无法判断温度的高低 D.上述说法都不正确
15.分别电解100mL 0.1mol·L-1的硝酸银和硫酸铜溶液,若还原的硝酸银和硫酸铜的物质的量之比为2:1,则下列叙述正确的是 ( )
A.在两个阴极上得到的银和铜的物质的量之比为2:1
B.在两个阳极上得到的产物的物质的理不相等
C.通过两溶液的电量不相等
D.电解过程中,两溶液中氢离子的物质的量都增加
|
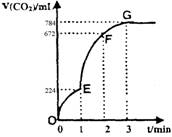
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率
为0.4mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳
表示的平均反应速率之比为2:6:7
D.G点表示收集的CO2的量最多
17.将等物质的量的下列有机物中足量氧气中完全燃烧,立即使生成的产物全部通入足量Na2O2固体中,充分反应后,固体质量增重相等的是 ( )
A.C2H6 C2H5OH B.C2H6 C3H6
C.C3H8 C3H8O3 D.HCHO CH3COOH
18.有m1 g KCl饱和溶液,其溶质的质量分数为c1%。改变温度或蒸发水后析出m3g KCl晶体,母液质量为m2g,其溶质的质量分为c2%。则下列关系一定正确的是 ( )
A.c1一定大于c2 B.m1-m3=m2
C.m1c1-m2c2=100m3 D.原条件下KCl的溶解度小于c1g
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共18分)
19.(8分)为测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取Wg固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g。
乙组:量取25.00mL上述溶液,加入足量的BaCl2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g。
丙组:量取25.00mL上述溶液,用amol·L—1酸性KmnO4溶液进行滴定。
(5SO32—+2MnO4—+6H+
5SO42—+2Mn2++3H2O),消耗KmnO4溶液的体积为bmL。
(1)配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和
。
(2)在丙组实验中滴定时是否需要选择指示剂 (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3)用丙组的实验数据,计算Na2SO3固体的纯度: 。
(4)实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因(用化学方程式表示) 。
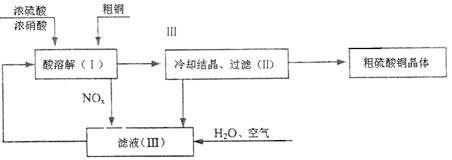
|
回答下列问题:
(1)配平在滤液(Ⅲ)中发生反应化学主程式:
NOx+ H2O+ O2= HNO3。
(2)写出制取硫酸铜的总反应方程式 。
(3)在上述生产过程中,被循环使用的物质是 。
|
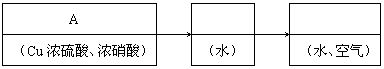 |
四、(本题包括2小题,共19分)
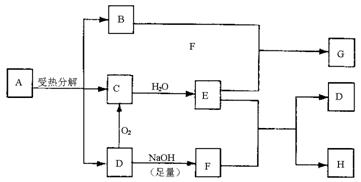
|
回答下列问题:
(1)写出G和H的化学式:G 、H 。
(2)工业生产中D转化为C的反应条件是: 。
(3)B跟E反应的离子方程式是 。
22.(11分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g)+Cl-(g) NaCl(s); △H B.Na(s)+![]() Cl2(g)
Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g);
△H3
E.![]() Cl2(g)
Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式 。
氯化亚铁晶体结构氯化钠晶体结构相似,则:
(3)氯化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为![]() ,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将 (填“减少”、“增多”或“保持不变”)。
五、(本题包括2小题,共20分)
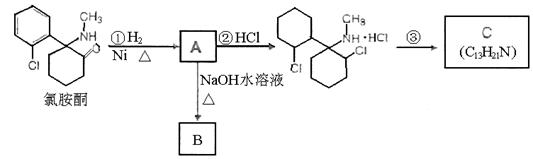
23.(10分)“摇头丸”中含有氯胺酮成分。氯胺酮在一定条件下可发生下列一系列转化:
|
(1)写出氯胺酮的分子式 。
(2)上述转化过程中发生取代反应的是 ,反应③的条件是 。
|
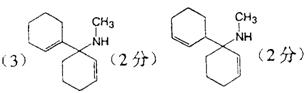
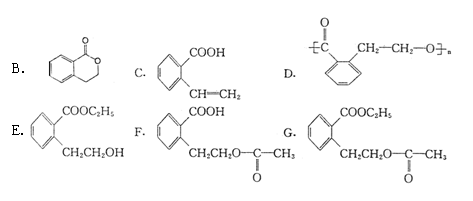 24.(10分)有机物A的结构简式为
,它可通过不同的反应分别得到下列物质:
24.(10分)有机物A的结构简式为
,它可通过不同的反应分别得到下列物质:
(1)在A~G中,不属于酯类的化合物有 (填写编号)。
(2)写出苯环上只有一个取代基,且组成上比A少一个碳原子的A的同系物的结构简式:
。
(3)在A~G中互同分异构体的是 。
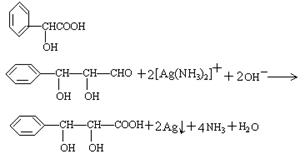
(4)A的一种同分异构体H,它能发生银镜反应,不发生水解反应。写出H与银氨溶液反应的化学方程式:
六、(本题包括2小题,共19分)
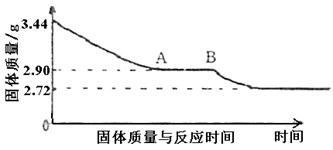
|
(1)石膏的化学式。
(2)图像中AB段对应化合物的化学式。
26.(12分)NaHCO3和KHCO3的固体混合物9.20g跟100mL盐酸反应。
(1)若NaHCO3和KHCO3的物质的量相同,
①欲求标准状况下生成CO2的体积,还需要什么数据? 。(在讨论②的问题中,该数据可用a表示)
②讨论:a值的变化对产生CO2体积(标准状况)的影响。
| a的取值范围 | 生成CO2的体积(L) |
(2)若NaHCO3和KHCO3物质的量不相同,则9.20g固体混合物与足量盐酸反应时,在标准状况下,生成CO2气体的体积(V)在什么范围?请写出推断(或计算)过程。
(3)若NaHCO3和KHCO3的物质的量之比为m,9.20g固体恰好能跟一定浓度的100mL稀盐酸完全反应,则稀盐酸物质的量浓度的表达式为 (用含m的式子表示)。
化学参考答案
一、1.A 2.C 3.D 4.B 5.C 6.D 7.B 8.B
二、9.AC 10.BD 11.A 12.A 13.A 14.B 15.AD 16.BD 17.AC 18.C
三、19.(8分)(1)250mL容量瓶(1分,答容量瓶也得1分)。 (2)不需要(1分),溶液由无色变成浅红色(1分) (3)![]() (3分) (4)2BaSO3+O2=2BaSO4(2分)
(3分) (4)2BaSO3+O2=2BaSO4(2分)
20.(10分)(1)4、2、(5-2x)、4(3分) (2)2Cu+O2+2H2SO4=2CuSO4+2H2O(3分)。
(3)HNO3(2分) (4)B、A(2分,各1分)。
四、21.(8分)(1)Fe2(SO4)3、Na2SO4(4分,各2分) (2)催化剂、适宜温度(2分,各2分)
(3)Fe2O3+6H+=3H2O(2分)
22.(11分)(1)A或△H(2分) (2)△H1=△H+△H2+△H4+△H5(3分) (3)6个(1分)
(4)![]() (3分) (5)不变(2分)
(3分) (5)不变(2分)
|
(3)
24.(10分)(1)A、C(2分,各1分) (3)B与C(2分)
|
|
(3分)(其它合理结构均可给分)
|
|
136+18x 136 18x
3.44G 2.72g 0.72g
石膏化学式为CaSO4·2H2O (3分。其中过程2分,结论1分)。
|
|
1172 136+18y
3.44g 2.90g
该化合物为2CaSO4·H2O(或CaSO4·![]() H2O)。(4分。其中过程3分,结论1分)
H2O)。(4分。其中过程3分,结论1分)
26.(12分)(1)①盐酸地物质的量浓度(1分); ②0<a<1、2.24a; a≥1、2.24(4分,1空格1分)。
(2)2.06<V<2.45(4分)。 (3)![]() (3分)
(3分)