高三化学质量模拟(一)
化学试题
本试题分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。全卷满分100分,考试时间90分钟。
第Ⅰ卷 (选择题 共45分)
可能用到的相对原子质量:H 1,C 12,N 14,O 16,Na 23,Cl 35.5,Fe 56
一、选择题(本题包括12个小题,每小题2分,共24分。每小题只有1个选项符合题意。)
1、常温下,新制氯水中Cl-、ClO-离子的浓度分别为amol·L-1、bmol·L-1,则a与b的大小关系为
A.a>b B.a<b C.a=b D.无法确定
2、含NaOH20.0的稀溶液与足量稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是
A、NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l)△H=+28.7kJ/mol
B、NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l)△H=-28.7kJ/mol
C、NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l)△H=+57.4kJ/mol
D、NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l)△H=--57.7kJ/mol
3、过氧化氢跟硫酸酸化的高锰酸钾溶液进行反应,生成硫酸钾、硫酸锰和氧气,如果过氧化氢中氢原子是示踪原子(![]() ),当反应结束后,含有示踪原子的物质是
),当反应结束后,含有示踪原子的物质是
A、氧气 B、水 C、硫酸锰 D、硫酸钾
4、实验室中保存下列化学药品的方法不正确的是
A、硝酸银溶液保存在棕色试剂瓶中
B、氢氧化钠溶液保存在带胶塞的无色细口试剂瓶中
C、钾、钠和白磷均保存在煤油中
D、溴水保存在磨口试剂瓶中并加少量水
5、某温度下,100g饱和氯化钠溶液中含有氯化钠26.5g。若向此溶液中添加3.5g氯化钠和6.5g水,则所得溶液的溶质质量分数是
A、30%
B、![]() ×100%
×100%
C、26.5%
D、![]() ×100%
×100%
6、下列叙述正确的是
A、常温下铝和浓硫酸、浓硝酸不反应
B、工业上常利用铝热反应冶炼难溶的金属、如钒、铬、锰等
C、合金的熔点一般比组成它的各成分的熔点都高
D、两分相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者较多
7、生活中遇到的某些问题,常常涉及到化学知识,下列分析正确的是
A、氯气和二氧化硫均可做漂白剂,若同时使用它们运河漂白某一湿润的物质,漂白效果会明显增强
B、 实现消除碘缺乏病的目标,卫生部规定食盐必须加碘,所加的碘以单质形式存在
C、 工业酒精中含有甲醇等杂质,不能用它勾兑饮用酒
D、目前,在我国的空气质量日报中,列为空气污染物的是二氧化硫、二氧化氮、二氧化碳等。
8、向分别含有下列四种离子的溶液中加入等质量的Na2O2,离子浓度变化最小的是
A、SO32- B、HCO3- C、Al3+ D、CO32-
9、具有下列特征的元素,一定属于非金属的是
A、原子最外层电子数大于4
B、最高价氧化物对应的水化物是酸
C、具有负化合价
D、具有可变化合价
10、在实验室加热50mL液体,需要使用的仪器是下列中的:①试管 ②烧杯 ③试管夹 ④酒精灯 ⑤蒸发皿 ⑥石棉网 ⑦铁架台(附铁圈) ⑧坩埚钳
A、①③④⑦ B、②④⑦ D、④⑤⑦⑧ C、②④⑥⑦
11、判断物质在不同溶剂中的溶解性时,有一条经验规则:“极性分子组成的溶质易溶于极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成都市的溶剂。”下列装置中,不适宜用作HCl气体尾气吸收的是

12、固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构。则下列有关说法中,不正确的是
A、1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数值)
B、NH5中既有共价键又有离子键,它形成的晶体是离子晶体
C、NH5的电子式为: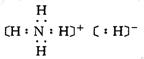
D、它与水反应的离子方程式为:NH4++H-1+H2O====NH3·H2O+H2↑
二、选择题(本题包括7个小题,每小题3分,共21分。每小题有1个或2个选项符合题意。当正确答案包括2个选项时,只选1个且正确的得1分,选2个且都正确的得3分。但只要错选1个,该小题即为0分。)
13、下列叙述中正确的是
A、电解池的阳极上发生氧化反应,阴极上发生还原反应
B、原电池跟电解池连接后,电子从原电池的负极流向电解池的阳极
C、电镀时,电镀池里的阳极材料发生氧化反应
D、电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气
14、有A、B两种烃,其含碳的质量分数相同,有关A和B的叙述正确的是
A、A和B一定是同分异构体
B、A和B不可能是同系物
C、A和B的最简式一定相同
D、物质的量相等的A和B完全燃烧生成CO2的质量一定相等
15、有A和M两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是
A、A和M的原子序数之差为8
B、A和M原子的电子总数之和可能是11
C、A和M原子的最外层电子数之和为8
D、A和M原子的最外层电子数之差为7
16、将4molA气体和2molB气体在2Lr 密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),若经2s后测得C的浓度为0.6mol·L-1,则下列说法正确的是
2C(g),若经2s后测得C的浓度为0.6mol·L-1,则下列说法正确的是
A、用物质A表示的平均反应速率为0.3mol·L-1·S-1
B、用物质B表示的平均反应速率为0.3mol·L-1·S-1
C、2s时物质A的转化率为70%
D、2s时物质B的浓度为0.7mol·L-1·S-1
17、下列反应的离子方程式书写正确的是
A、向沸水中滴入饱和氯化铁溶液 Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B、向漂粉精溶液中通入二氧化碳
Ca2++2ClO-1+H2O+CO2====CaCO3↓+2HclO
C、向氢氧化钡溶液中加入稀硫酸 H++SO42-+Ba2++OH-====BaSO4↓+H2O
D、碳酸氢钾溶液中加入少量澄清石灰水
2HCO3-+Ca2++2OH-====CaCO3↓+CO32-+2H2O
18、在一个不传热且容积固定的密闭反应器里,有可逆反应:
mA(g)+nB( g)![]() pC(g)+qD(g)
pC(g)+qD(g)
当m、n、p、q为任意正整数时,该反应达到平衡的标志是 ①体系的压强不再发生变化;
②体系的温度不再发生变化;③各组分的物质的量浓度不再发生变化;④各组分的质量分数不再发生变化;⑤反应速率vA∶vB∶vC∶vD=m∶n∶p∶q;⑥单位时间内,若消耗了m molA物质,同时也消耗了q molD物质
A、①③⑤ B、①④⑥ C、②③④⑥ D、③④⑤⑥
19、某有机物的结构简式为 ,它可以发生的反应类型有 ①取代
,它可以发生的反应类型有 ①取代
②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦加聚
A、①③⑤⑥ B、②④⑥⑦ C、①②③⑤⑥ D、①③⑦
潍坊市二○○三年高三统一考试
化学试题
第Ⅱ卷 (非选择题 共55分)
三、(本题包括2小题,共16分)
20、(6分)今有下列试剂:①Cu ②MnO2 ③电石 ④Na2SO3固体 ⑤锌粒 ⑥蒸馏水 ⑦双氧水 ⑧浓H2SO4 ⑨浓HNO3 ⑩稀盐酸
从以上试剂中选取适当物质,用下图装置制取和收集气体,根据装置分析后填表(
写化学式,可不填满,也可补充)

| 编号 | C中气体 | 有关反应的化学方程式 |
| (1) | ||
| (2) | ||
| (3) |
21、(10分)有甲、乙两个化学兴趣小组,分别做了乙醇催化并验证产物的实验。甲组实验设计如图1所示,乙组实验设计如图2(密闭系统内空气很少)所示

请填写下列空白:
(1) 甲组要完成全部实验内容有如下步骤,正确的顺序是(填写编号,步骤可重复)_____________。
a.加热 b.检查装置的气密性
c.向A中缓级鼓入干燥的空气 d.取下D装置
(2)甲、乙两组实验中,给定的A、B、E、H中需要加热的是(填定装置编号)_____________。
(3)反应开始后,C中观察到的现象是______________________________。
(4)写出E中发生反应的化学方程式:______________________________。
(5)简述新制Cu(OH)2浊液的配制方法_____________________________________
____________________________________________________________________________。
(6)写出D中反应的化学方程式_______________________________________________。
四、(本题包括2小题,共17分)
22、(10分)在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。请回答下列问题。
(1) 在实验过程中水的电离程度的变化趋势是先_______________后_____________。(填“增大”、“减小”或“不变”)
(2) 在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
| 编号 | 离子浓度大小顺序 | 溶质的化学式 | 溶液的Ph |
| ① | C(NH4+)>c(OH-)>c(Cl-)>c(H+) | PH>7 | |
| ② | C(NH4+)=c(Cl-) | NH4Cl和NH3·H2O | |
| ③ | NH4Cl | PH<7 | |
| ④ | C(Cl-)>c(H+)>c(NH4+)>c(OH-) | PH<7 |
23.(7分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:

(1)A是 ,B是 ,C是 (填化学式)
(2)反应⑥的化学方程式为: 。
(3)反应④的离子方程式为: 。
五、(本题包括2小题,共15分)
24.(7分)常温常压下,只含C、H、O三种元素的某些有机物在足量的氧气中充分燃烧,恢复到室温后,其燃烧消耗氧气的物质的量与燃烧后生成气体的物质的量相等。试回答。
(1)符合此要求且相对分子质量最小的有机物A的结构简式为 。
(2)符合此要求且相对分子质量是有机物A的2倍的有机物的结构简式可能为
。
(3)A的同系物中,碳原子数为5的同分异构体的结构简式为 、
、 、 。
25.(8分)已知溴乙烷跟氰化钠反应后再水解可以得到丙酸,CH3CH2Br![]()
CH3CH2CN![]() CH3CH2COOH,产物分子比原化合物分子我我了一个碳原子,增长了碳链。请根据以下框图回答问题。
CH3CH2COOH,产物分子比原化合物分子我我了一个碳原子,增长了碳链。请根据以下框图回答问题。

其中,F分子中含有1个八元环结构。
(1)反应①②③中属于取代反应的是 (填反应代号)。
(2)写出结构简式:E ,F 。
(3)写出B→D的化学方程式 。
六、(本题包括1小题,共7分)
26.(7分)2.24g铁与100mL稀硝酸混合后充分反应,产生气体NO,铁、硝酸均无剩余。向反应后的溶液中加入50.0mL 0.200mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原,求原硝酸溶液的物质的量浓度。
高三化学质量模拟(一)答案
一、选择题
1A 2D 3A 4C 5C 6B 7C 8D 9C 10D 11C 12A
二、选择题
13AC 14C 15B 16AD 17BD 18C 19C
三、20.
(1)NO2;Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
(2)SO2;Na2SO2+H2SO4(浓)===Na2SO4+SO2↑+H2O
21.(1)bacda或bcada
(2)A B E H (2分,少一个扣1分,扣完为止)
(3)固体由白色变蓝色
(4)CuO+CH3CH2OH![]() Cu+CH3CHO+H2O
Cu+CH3CHO+H2O
(5)在盛有NaOH溶液的试管中,加入几滴CuSO4溶液
(6)CH3CHO+2Cu(OH)2![]() Cu2O↓+CH3COOH+2H2O
Cu2O↓+CH3COOH+2H2O
四、22.(1)增大;减小
(2)①NH3·H2O和NH4Cl
②pH=7
③c(Cl-)>c(NH4+)>c(H+)>c(OH-)
④HCl和NH4Cl
23(1)Fe;Cl2;H2
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)2
(3)2Fe2++Cl2====2Fe3++2Cl-
五、24.(1)HCHO
(2)CH3COOH,HCOOCH3

六、26.由Fe3+得电子的物质的量等于I-失电子的物质的量,有:
n(I-)=0.200mol·L-1×0.0500L=0.0100mol
所以n(Fe3+)=0.0100mol
而n(Fe)=![]() =0.0400mol
=0.0400mol
所以n(Fe2+)=0.0400mol-0.0100mol=0.0300mol
再由氧化剂HNO3得电子的物质的量等于Fe失电子的物质的量,
即:n(Fe2+)×2+n(Fe3+)×3=n(NO)×3
所以n(NHO3)=0.0300mol+0.0300mol×2+0.0100mol×3=0.120mol
所以HNO3的浓度为:c(HNO3)=![]() =1.20mol·L-1
=1.20mol·L-1
答:原硝酸溶液的物质的量浓度是1.20mol·L-1。
(其它合理答案也得分)