高三化学总复习专题:硫和硫的化合物
一、选择题(每一小题可能有1-2个选项符合题意)
1、关于氧化钠和过氧化钠的叙述中正确的是:
A、都可与CO2和H2O反应且都有同一种物质生成 B、都能漂白有色物质
C、露置于空气中最终能变成同种物质 D、均能和盐酸反应只生成盐和水
2、关于碱金属元素随原子序数递增,其性质递变规律,不正确的叙述是
A、单质的密度依次增大 B、单质的熔沸点依次降低
C、单质的还原性依次增强 D、离子的氧化性依次减弱
3、下列各组中的两物质反应时,反应条件或反应物用量的改变对生成物没有影响的是:
A、Na2O2与CO2 B、Na与O2 C、NaOH与CO2 D、C与O2
4、Na2O2和过量NaHCO3混合,在密闭容器中加热,最后排出气体后,残留的固体物质是:
A、Na2O和Na2O2 B、Na2O2和Na2CO3 C、Na2CO3 D、Na2O2、NaOH和Na2CO3
5、可用于判断NaHCO3粉末中混有Na2CO3的实验方法是:
A、加热时有无气体放出 B、滴加盐酸时有无气体放出
C、溶于水后,滴加澄清石灰水,有无白色沉淀生成
D、溶于水后,滴加BaCl2溶液,有无白色沉淀生成
6、已知钡的活动性介于钾与钠之间,则下列说法能实现的是:
A、钡可从氢氧化钠溶液中置换出钠 B、钡能与水剧烈反应产生氢气
C、钡可以从氯化钾溶液中置换出钾 D、钡与水的反应比钾与水的反应剧烈
7、盛下列物质的容器敞口久置,其质量减少的是:
A、浓H2SO4 B、浓盐酸 C、Na2O2 D、结晶碳酸钠
8、有由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向混合物加入足量盐酸,有气体放出。将放出的气体通过过量的NaOH溶液后,气体体积有所减少。若将上述混合物在空气中充分加热也有气体放出,且加热后残留固体物质的质量比加热前有所增加,下列判断中正确的是
A、混合物中一定有Na2O、Na2O2、NaHCO3 B、混合物一定不含有Na2CO3和NaCl
C、混合物中是否含有Na2CO3和NaCl无法确定 D、混合物中一定不含有Na2O2和NaCl
9、K35ClO3晶体与H37Cl溶液反应后生成氯气、氯化钾和水,此反应生成氯气的式量是
A、73 B、73.3 C、72 D、70.6
10、向溶有90gNaI的溶液中加入40g溴,再接着向溶液中通入过量的Cl2,充分反应后被还原的Cl2的质量是(不考虑Cl2、Br2与H2O反应)
A、42.6g B、17.75g C、21.3g D、7.1g
11、用下列三种方法制取氯气:①电解食盐水;②二氧化锰跟浓盐酸反应;③KMnO4+HCl(浓)→MnCl2+KCl+Cl2+H2O,若三个反应中参加反应的氧化剂都是1mol,则生成氯气的物质的量之比是
A、5:4:8 B、8:4:5 C、5:2:1 D、1:2:5
12、有一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
A、一定含有I-,不能确定是否有Cl- B、一定含有NO3-
C、不含有Fe3+ D、一定含有I-、NO3-和Cl-
13、下列物质:①硫水钠溶液;②二氧化硫饱和溶液;③硫酸铜溶液;④硝酸银溶液。其中既能跟硫化氢反应,又能跟溴水反应的是
A、①②③④ B、①②④ C、①③ D、仅②④
14、下列溶液暴露置于空气中,开始一段时间其pH值变小的是(不考虑溶质挥发)①H2S;②H2SO3;③Na2S;④Ca(OH)2;⑤氯水;⑥Na2SO3
A、①②④ B、②⑤⑥ C、①②④⑤ D、②④⑤⑥
15、在200ml 0.2mol/L NaOH溶液中通入一定量SO3气体,在一定条件下蒸发所得溶液,析出的固体物质只有4.5g,该固体物质的成分可能是
①Na2SO4 ②NaHSO4 ③Na2SO4·10H2O ④NaHSO4·10H2O
A、只有① B、只有② C、①③ D、②④
16、已知98%的硫酸物质的量浓度为18.4mol/L,则49%的硫酸物质的量浓度(mol/L)是
A、等于9.2 B、大于9.2 C、小于9.2 D、无法确定
17、下列试剂的保存方法错误的是( )
A.用棕色瓶保存氯水 B.用玻璃瓶保存氢氟酸
C.用玻璃瓶保存烧碱 D.液溴用水封密闭保存
18、某氯碱厂利用废铁皮制取净水剂FeCl3溶液,下列途径中最合理的是
A.Cl2![]() FeCl3
FeCl3![]() FeCl3溶液
FeCl3溶液
B.Cl2![]() HCl
HCl![]() 盐酸
盐酸![]() FeCl2溶液
FeCl2溶液![]() FeCl3溶液
FeCl3溶液
C.Cl2![]() HCl
HCl![]() 盐酸
盐酸![]() FeCl2溶液
FeCl2溶液![]() FeCl3溶液
FeCl3溶液
![]() D.Cl2、H2
D.Cl2、H2![]() HCl
HCl![]() 盐酸
盐酸
废铁![]() Fe2O3
→FeCl3溶液
Fe2O3
→FeCl3溶液
19、在标准状况下有22.4L氯气和氢气的混合气体,在一密闭容器中充分反应后,将此气体冷却与1L1 mol/L的NaOH溶液充分反应,最后此溶液
A.一定显酸性 B.一定显碱性
C.可能显酸性,可能显碱性,可能显中性 D.以上答案均不正确
20、下列萃取与分液结合进行的操作(以煤油为萃取剂从碘水中萃取碘)中,错误的是
A.饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,用手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来,用力振荡。
B.静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯壁慢慢流出
D.最后继续打开活塞,另用容器承接并保存上层液体
二、填空题
21、将amol Na2O2和b mol NaHCO3混合置于密闭容器中,加热至300℃使其充分反应,回答下列问题:
(1)当充分反应后密闭容器内气体只有O2时,a和b的关系是 。
(2)当充分反应密闭容器内固体只有Na2CO3时,a和b的关系是 。
(3)当充分反应后密闭容器内固体为Na2CO3和NaOH混合物时,a和b的关系是 。
22、把一瓶不饱和的NaOH溶液为四等份,在保持温度不变的情况下,向四份溶液中分别加入NaOH、Na2O2、Na2O、Na这四种固体,都使溶液恰好达到饱和,则加入的物质质量最大的是 ,这是因为 。
23、多硫酸是H2SO4的缩合酸,焦硫酸是两个硫酸分子缩合后的产物。已知H2SO4的结构
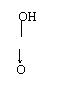 |
式为HO—S→0 , 则焦硫酸的结构式为 ,若有n个H2SO4分子
缩合,其缩合产物的结构式为 ,其中硫氧键的数目有 个。对应的酸根的化学式为 。
24、用图示装置制取PCl3,在反应管D中放入足量的白磷,将氯气不间断地通入,氯气与白磷就会发生反应,产生火焰,PCl3和PCl5物理常数如下表.
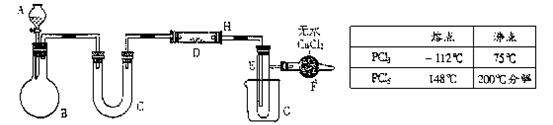 |
(1)为迅速得到的持续的氯气,若B中装的是MnO2,则A中应加________,对B还须_______。
(2)PCl3遇水会强烈水解,所以D、C、E仪器以及其中所装物质不可含水分。为此C中应装入_______,作用是___________;生成的PCl3在E中收集,为使PCl3冷凝,应在G中加入_________;在E的支管处所连接的仪器的名称是_________,其中所装无水CaCl2的作用是_______________,H处导管需较长且较粗的原因是__________。
(3)装置末端导出的气体应用__________溶液进行处理,目的是____________。若要省去最后的溶液处理装置而不会影响整个实验,必须将K中无水CaCl2换成_________。
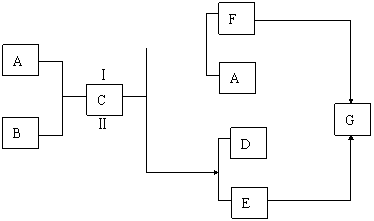
25、下框中的每一方格表示有关的一种反应物或生成物(生成C时的其他产物或其他反应中生成的水已略去),其 A、F为酸,D、E为盐。C、G为气体。
 光
光
冷水
![]()
热KOH
溶液
(1)物质D是_______,F是_________。
(2)写出C与热KOH溶液质应的化学方程式,并标出电子转移的方向和数目。
(3)n molC无论按途径(Ⅰ),还是按途径(Ⅱ)最终生成的G的物质的量均为_______mol。其本质原因是__________。
26、一种含有X元素的化合物A,X是短周期元素,在A中X元素为+4价.从A的水溶液出发进行一系列的转化,如图所示:
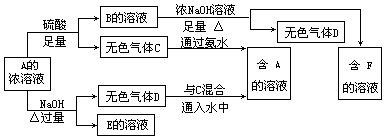
(1)A中含有的X元素可能是:____________________;
(2)如要确认X元素是哪一种,还应继续做什么实验:_____________________;
(3)请写出你所确认的含有X元素的化合物A与过量NaOH溶液反应的离子方程式: 。
三、计算
27、H2SO4是SO3的水合物,设某种(90%)浓H2SO4存在着三种水合物形式:H2SO4(SO3·H2O)、H2S2O7(2SO3·H2O)、H2SO4·2H2O(SO3·3H2O),若SO3·3H2O的质量占了一半,那么H2SO4与H2S2O7的物质的量之比为多少?
28.(12分)用NaOH、H2O、大理石和盐酸制取33 g纯NaHCO3,请参照物质的溶解度回答下列问题:
| 25℃ | 溶解度/g |
| NaOH | 100 |
| NaHCO3 | 9 |
| Na2CO3 | 30 |
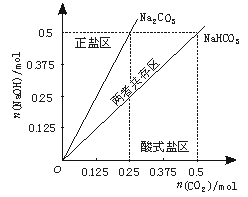
(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
(4)在上图反映上述实验过程的图象中,标出A点[即当n(CO2)/n(NaOH)=1/3,且n(CO2)=0.125 mol]的位置,并判断此时所得盐的组成及其物质的量。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| AC | A | A | C | D | B | BD | AC | B | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | B | D | C | C | B | B | C | D |
21.(1) a≥ b (2)b ≥2a (3) a<b<2a
22.NaOH
23. 4n,SnO3n+12-
24.(1)浓盐酸 , 加热
(2)无水氯化钙 ,干燥;冰水;干燥管,防止空气中的水蒸汽进入E中,防止堵塞导管
(3)氢氧化钠,除去氯气、氯化氢等气体,碱石灰
25.(1)KCl,HClO
(2)3Cl2+6KOH=5KCl+KClO3+3H2O
(3)0.5n, 得失电子数相等
26.(1)碳或硫
(2)将无色气体C通人品红溶液
(3)NH4++OH-=NH3+H2O
27.163:191
28.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑,CO2+NaOH=NaHCO3
(2)20g
(3)在氢氧化钠溶液中通人过量二氧化碳,过滤
(4)Na2CO3 0.125mol