第二章 高三碱金属复习一(钠及其化合物)
学习目标:了解碱金属的性质;了解Na2O和Na2O2的性质;掌握氢氧化钠的性质和用途;掌握碳酸钠和碳酸氢钠的区别和联系用二者的鉴别方法;从物质结构上理解碱金属元素(单质、化合物)的相似性和递变规律;了解焰色反应的概念及操作方法。
疑难点拔:
1、单质钠的化学性质:
钠原子最外层只有一个电子,在反应中极易失去这个电子,所以单质钠具有强还原性,可与非金属单质(如:O2、X2、S等)反应,也可与水、酸、盐溶液和熔融的盐等到反应。在复习这些反应时应注意发下几点:
(1)不同条件下钠与氧气(或空气)反应的现象、反应物的用量、产物的结构和稳定性不同;
(2)钠与水反应的现象的原因解释;
(3)钠与水、酸、盐溶液的反应,实质上是钠原子与水或酸电离出的H+的反应,所以H+浓度不同,反应剧烈程度不同;
(4)金属活动顺序表吵氢后面的金属阳离子的氧化性虽然强于H+,但其反应速率远小于钠原子与H+的反应速率,故金属钠投入盐溶液中首先是与水的反应;然后再分析NaOH是否与盐发生复分解反应。如果是铝盐溶液,还要考虑钠和铝盐的量的问题,因过量的NaOH能溶解Al(OH)3;
(5)工业上利用钠作还原剂把钛、锆、铌、钽等金属从它们的熔炉融卤化物中还原出来,不能有水的参与;如:![]() 。
。
2、Na2O与Na2O2的比较:
| 氧化物 | Na2O | Na2O2 |
| 电子式 |
|
|
| 属类 | 可溶性碱性氧化物 | 非碱性性氧化物 |
| 生成条件 | 常温下缓慢氧化 | 燃烧或加热 |
3、Na2CO3与NaHCO3比较:
| 名称 | 碳酸钠 | 碳酸氢钠 |
| 俗名 | 纯碱或苏打 | 小苏打 |
| 水溶性 | 易溶于水,溶液呈碱性 | 易溶于水(比碳酸钠溶解度小),溶液呈碱性 |
| 稳定性 | 稳定,但晶体碳酸钠易风化 | 受热易分解 |
| 与H+反应 | CO32-+2H+=CO2↑+H2O | HCO3-+H+=CO2↑+H2O |
| 与硫酸铝等盐反应 | 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
| 相互转化 |
| |
典型例题分析:
例1:将同样大小的金属钠,分别加入①MgCl2溶液 ②饱和NaCl溶液 ③NH4Cl溶液中,各发生什么现象?主要生成物是什么?
。
例2:可能由CO、CO2和O2组成的混合气体30mL,通过足量的Na2O2,经充分反应后,气体体积变为25mL,引燃剩余气体,恢复到原温度,测得体积变为20mL(气体体积为相同条件下测得)。求原混合气体中O2的体积是多小mL?
例3:将mmolNaHCO3和nmolNa2O2的固体混合物置于密闭容器中,加热到250℃时,使其充分反应。当n/m的比值在不同范围时,分析最后生成的气体和残余固体的可能组成是什么?
课堂练习:
1、下列叙述不正确的是:
A、Na的化学性质很活泼,它在自然界中不能以游离态存在
B、Na2CO3比NaHCO3热稳定性强
C、Na2O与Na2O2都能与水反应产生,同时放出O2
D、等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,Na2CO3放出的CO2比NaHCO3少
[答案: C、D ] [解析: ]
2、下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是:
A、Na和O2 B、NaOH和CO2 C、Na2O2和CO2 D、NaCl和浓H2SO4
3、钠的下列用途与钠的化学性质无关的是:
A、制取过氧化钠 B、作原子反应堆的导热剂 C、冶炼金属钛 D、应用在电不源上
4、下列物质中能使品红试液褪色的是:①活性碳 ②过氧化钠 ③次氯酸钠 ④二氧化硫 ⑤干燥氯气 ⑥双氧水 ⑦臭氧
A、除①以外都可以 B、除⑤以外都可以 C、只有②③④⑥⑦可以 D、全部都可以
5、下列各组比较不正确的是:
A、熔点:![]() B、碱性:
B、碱性:![]()
C、还原性:![]() D、密度:
D、密度:![]()
6、下列钠元素的化合物,无天然存在的是:
①氧化物 ②氢氧化物 ③碳酸盐 ④硝酸盐 ⑤硫酸盐
A、①② B、除④外 C、除④⑤ D、不属于上述组合
7、2.3g钠放入100g水中,所得溶液的质量分数是
A、等于2.3% B、大于2.3% C、等于4% D、大于4%
8、欲除去小苏打溶液中少量的苏打,最好选用:
A、盐酸 B、苛性钠 C、通二氧化碳 D、石灰水
9、下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是:
A、2Na2O2+2H2O=4NaOH+O2↑ B、2Na+2H2O=2NaOH+H2↑
C、2F2+2H2O=4HF+O2 D、Na2O+H2O=2NaOH
10、下列共存各组的离子通常只能用焰色反应来鉴别的一组是:
A、Ca2+、Cu2+、Mg2+ B、K+、Na+、Ba2+ C、K+、Ba2+、Ag+ D、Na+、Cu2+、Ba2+
11、向紫色石蕊试液中加入过量Na2O2粉末,振荡,下列叙述中正确的是:
A、溶液仍为紫色,并有气泡产生 B、最后溶液变蓝色,并有气泡产生
C、最后溶液褪色,并有气泡产生 D、最后溶液变红,色并有气泡产生
12、含有锂和另一种碱金属组成的混合物,取1.9g与水充分反应后,得到0.1gH2,则另一种碱金属可能是:
A、Na B、K C、Rb D、Cs
13、在甲、乙、丙、丁4个烧杯中分别加入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌使固体完全溶解,则甲、乙、丙、丁的溶液质量分数大小顺序是:
A、甲<乙<丙<丁 B、丁<甲<乙=丙 C、甲=丁<乙=丙 D、丁<甲<乙<丙
14、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过
中的某几种组成的混合物,向混合物中加入足量的盐酸有气体放出,将放出的气体通过![]() 的溶液后,气体体积减少;若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前有所增加,下列推断正确的是
的溶液后,气体体积减少;若将上述混合物在空气中充分加热,也有气体放出,且加热后残留固体物质的质量比加热前有所增加,下列推断正确的是
A、混合物中一定不含有![]() B、混合物中是否含有
B、混合物中是否含有![]() 和
和![]() 无法确定
无法确定
C、混合物中一定不含有![]() 和
和![]() D、混合物中一定不含有
D、混合物中一定不含有![]() 和
和![]()
15、有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2克,把它们溶于足量的水中,充分反应后,溶液中的Ca2+、CO32-和HCO3-均转化为沉淀,将反应容器中的水分蒸干,最后得到白色固体共29克, 则原混合物中Na2CO3的质量为:
A、10.6克 B、5.3克 C、5.9克 D、无法确定
16、氢化钠(NaH)是一种白色晶体,其中钠为+1价,氢化钠和水反应放出氢气,下列叙述正确的是
A、NaH溶于水显酸性 B、NaH和水反应时,水为还原剂
C、NaH中氢离子被氧化成H2 D、NaH中氢离子半径小于锂离子
17、有关Na2CO3, NaHCO3的题目:
(1) 纯碱________苏打______ 小苏打_______;
(2) 受热不稳定的是_____ 溶解度较大的是_____ 与同浓度盐酸反应更剧烈的是_______; 滴入CaCl2溶液变浑浊的是_____;既能与HCl反应又能与NaOH反应的是_______;加入澄清石灰水能出现浑浊的是________________;
(3) Na2CO3中含有少量NaHCO3固体如何提纯? ;
(4) Na2CO3与NaHCO3有哪些方法区别? 哪种方法最简单? ;
18、在三个密闭容器中分别装有:A、Na2O2和NaHCO3,B、Na2O2和NH4HCO3,C、Na2O2和Ca(HCO3)2,其中每种物质均有1mol。将它们加热至300℃,经充分反应后排出气体。写出各容器内残留固体物质的名称及其物质的量:A ______________B____________ C_______________。
19、①往![]()
![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 盐酸,先无气体放出,后有气体生成。发生的反应的离子方程式依次为:
盐酸,先无气体放出,后有气体生成。发生的反应的离子方程式依次为:
、 。
②往![]() 、
、![]()
![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 、
、![]() 盐酸放出标况下气体A
盐酸放出标况下气体A![]() ;往
;往![]() 、
、![]() 盐酸溶液中逐滴滴入
盐酸溶液中逐滴滴入![]() 、
、![]()
![]() 放出标况下气体B
放出标况下气体B![]() 。则:A∶B= ∶
。
。则:A∶B= ∶
。
20、为了测定某种碱金属的相对原了解质量而设计的装置如右图。该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。则: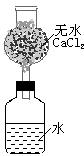
(1)列出计算该碱金属相对原子质量的数学表达式: 。
(2)无水氯化钙的作用是: 。
(3)如果不用CaCl2,求出的相对原子质量比实际相对原子质量偏大还是偏小 ,理由是 。
21、“二氧化碳是否在有水存在时才能 与过氧化钠反应?”这个问题,实验室里可通过以下实验加以证明。
(1)按图装置,在干燥的试管Ⅲ中装入 Na2O2后,在通入CO2之前,应事先关闭塞K1和K2,目的是什么?____________________________________________________;
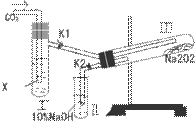 (2)试管Ⅰ内的试剂X应该是__________,打开活塞K1和K2,通入CO2一段时间后,将带火星的木条插入试管Ⅱ的液面上,可观察到带火星的木条不能燃烧,且Ⅲ内淡黄色粉未没发生变化,则所得的结论是_______________________________________________;
(2)试管Ⅰ内的试剂X应该是__________,打开活塞K1和K2,通入CO2一段时间后,将带火星的木条插入试管Ⅱ的液面上,可观察到带火星的木条不能燃烧,且Ⅲ内淡黄色粉未没发生变化,则所得的结论是_______________________________________________;
(3)试管Ⅰ试剂为CO2饱和水溶液时,其它操作同(2)通过____________________________________________的现象来证明过氧化钠与潮湿的CO2能反应且放出O2;
(4)CO2与过氧化钠的反应机理也可用示踪原子分析加以证明,请根据以上的实验结论,完成下列反应的化学方程式:Na218O2+CO2+H2O→__________________________________。
22、取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL1.00mol/L过量盐酸反应,生成2.016L CO2(标准状况下),然后加入500 mL0.100 mol/LBa(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0 mL1.00mol/L盐酸恰好完全中和.计算混合物中各物质的质量.
23、已知在10℃时![]() 的溶解度为29g,
的溶解度为29g,![]() 的溶解度为8 g。在常温下,将0.5mol的
的溶解度为8 g。在常温下,将0.5mol的![]() 溶于200g水中,然后通入过量的
溶于200g水中,然后通入过量的![]() ,再冷却到10℃时, 最后会析出晶体多少g ?
,再冷却到10℃时, 最后会析出晶体多少g ?
参考答案:课堂练习
1、 CD2、C3、BD4、D5、D6、A7、B8、C9、A10、B11、C12、C13、B14、B15、A16、C
17、(1)Na2CO3 Na2CO3 NaHCO3
(2)NaHCO3 Na2CO3 NaHCO3 NaHCO3 Na2CO3和NaHCO3
(3)加热 (4)a:测PH值 b:加CaCl2溶液 c:加同浓度的盐酸
18、A:Na2CO3 1 mol NaOH 1 mol B:Na2CO3 1 mol C:CaCO3 1 mol Na2CO3 1mol
19、CO32- + 2H+ =CO2 + H2O HCO3- + H+ = CO2 + H2O
A : B= 8: 9
20、(1)a/(a+b-c)(2)吸收从反应容器中跑出去的水蒸气
(3)偏小 由于水蒸气的散失,使C值减小,结果偏小
21、(1)防止有水蒸气进入试管
(2)干燥的氢气不与过氧化钠反应
(3)用带火星的木条靠近试管口,木条复燃,且试管内浅黄色的固体变为白色
(4)2Na218O2 + 2CO2 +2H2O = 2Na2CO3 + 18O2 +2H218O
22 、Na2SO4 1.42g Na2CO3 7.42g NaHCO3 1.68g
23、68.72g