专项测试28高三化学实验方案的设计
湖南省东安一中 夏尊华(425900)
设计意图
(1)根据实验试题要求,设计基本实验方案;(2)训练根据实验目的及原理,选择合适的仪器和药品,设计可行的操作步骤;(3)培养根据实验的要求,设计制备实验和性质实验两种实验方案的实验能力;(4)培养认真严谨的科学态度,科学、合理、周密、安全的实施化学实验。
测试时间:45分钟 本卷总分:100分
选择题(8×4=32分)
1、要提取食盐中的单质碘,你设计的最佳方法是 ( )
A、萃取 B、重结晶 C、加热 D、过滤
 2、氯化苄(C6H5CH2Cl)由甲苯和氯反应而合成,反应条件是
(
)
2、氯化苄(C6H5CH2Cl)由甲苯和氯反应而合成,反应条件是
(
)
A、浓硫酸存在下 B、加热
C、铁粉催化 D、光照
3、提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为 ( )
A、加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B、加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C、加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D、加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
4、某溶液含有较多的 Na2SO4 和少量的 Fe2(SO4)3 ,若用该溶液制取芒硝,可供选择的操作有:①加适量 H2SO4 溶液②加金属 Na ③结晶④加过量 NaOH ⑤加强热脱结晶水⑥过滤。正确的操作步聚是 ( )
A、②⑥③ B、④⑥①③
C、④⑥③② D、②⑥①③⑤
5、在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3)投入烧杯中。观察到的现象可能是 ( )
A 钠在水层中反应并四处游动 B 钠停留在苯层中不发生反应
C 钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处反应并可能作上、下跳动
6、学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上
喷洒某种试剂,挂在铁架台上。另取一只盛有某种
 液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
(
)
液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色纸蝴蝶上的喷洒液转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
(
)
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
| 小烧坏中的溶液 | 浓盐酸 | 浓氨水 | 氢氧化钠溶液 | 浓硫酸 |
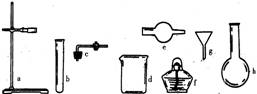
7、在没有现成的 CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的,能随开随用,随关随停的 CO2气体发生装置。应选用的仪器是(填入仪器的编号)。
A、abcd B、degh C、bcd D、acde
8、为实现我国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知溶液中IO3-可以与I-发生如下的反应:IO3-+5 I-+6H+ == 3I2+3H2O
据此反应,可用试剂和一些生活中常见的物质进行试验,证明在食盐在存在着IO3-。可供选用的物质是:①自来水
②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒。进行上叙实验时必须使用的物质是
( )
A、①③ B、③⑥
C、②④⑥ D、①②④⑤⑦
 9、(5分)以下气体:①H2 ②Cl2 ③CH4 ④NO ⑤SO2 ,(烧瓶的位置不能移动)
9、(5分)以下气体:①H2 ②Cl2 ③CH4 ④NO ⑤SO2 ,(烧瓶的位置不能移动)
(1). 若烧瓶是干燥的,则由A口进气,可收集的气体是 ,由B口进气,可收集的气体是 。
(2). 若烧瓶内充满水,可收集到的气体是 ,气体应由 口进入(填A或B) (3). 若在烧瓶内装有一定量的溶液,用以洗气,则气体应从 口进入 (填A或B)
10、(10分)某工厂废液经测定得知含有乙醇、甲醇、乙酸和乙酸乙酯。现欲从废液中回收甲醇、乙醇和乙酸,根据各物质的性质 (见下表) ,补充下列实验步骤,并回答有关问题:
| 物质 | 甲醇 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 65 | 77 | 78 | 118 |
可供选择的实验用品:250 mL 蒸馏烧瓶,400 mL 烧杯,250 mL 烧杯,温度计,冷凝器接受器,玻璃棒以及中学化学实验的常用仪器。1摩尔/LNaOH 溶液, 18.4 mol/LH2SO4 溶液,蒸馏水和冰
(1)补充下列实验步骤,直至达到实验目的。
第一步:组装蒸馏装置,检查其气密性;
第二步:取100 mL 废液注入250 mL 蒸馏烧瓶中,滴入1 mol/LNaOH溶液,调整废液的pH=10 ;
第三步:___________________________ 。
第四步:_______________________ 得甲醇。
第五步:__________________________得乙醇。
第六步:__________________________
得乙酸。
(2)滴入 1 mol/LNaOH 溶液,使溶液的 pH=10 的目的是______________
。
( 3 )使用 18.4 mol/LH2SO4 目的是(用化学方程式表示)_____________________ _。
 11、(14分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,而是灰绿色转为红褐色的沉淀,请回答:
11、(14分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,而是灰绿色转为红褐色的沉淀,请回答:
(1)滴管下端插入液面的原因是________
_ ;生成红褐色沉淀的化学方程式为______
_ ;此反应中的02可能来自于___________
。
(2)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
②除去蒸馏水中溶解的O2常采用 的方法。
③生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
。
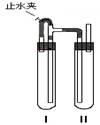 方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
①在试管I里加入的试是 。
②在试管II里加入的试是 。
③为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞子后的实验步骤是
。
④这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
。
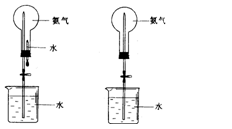 12、(15分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
12、(15分)制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: ;收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(2)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷泉的操作是
。该实验的原理是
。
(3)某同学用氨气做喷泉实验时,喷入烧瓶内的水不足烧瓶容积的三分之一,其原因可能是( )
① 瓶塞漏气 ② 用胶头滴管挤入的水太少
③ 喷水用的导管太长 ④烧瓶内未集满氨气,尚有大量空气
A、①②④ B、①③④ C、②③ D、①②③④
(4)在体积为1L的干燥烧瓶中,用排空气法收集氨气后,测得烧瓶中气体的密度是氧气的0.625倍。以此气体进行喷泉实验,当喷泉停止后,进入烧杯中水的体积是( )
A、1/4L B、1/2L C、3/4L D、1L
(5)如果只提供如图2的装置,请说明引发喷泉的方法
。
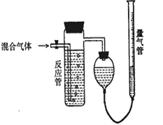 13、(10分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
13、(10分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写混合气体的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替 (填物质的名称)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的体积为Vb mL(已折算成标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为 。(填写下列仪器似的编号)
a烧杯 b试管 c广口瓶 d容量瓶 e量筒 f单孔塞 g双空塞
| |
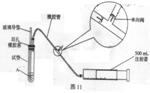
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后
(填写操作方法)时,将会看到 (填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005mol·L-1的碘水1.0mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由 色变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为
。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
| 浓度限值/mg·m-3 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500mL)。请将下表填写完整(计算时保留2倍有效数字):
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| SO2含量/mg·m-3 |
判断该地点的空气中SO2的含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)
。
1.C 利用固态碘受热易升华的性质,采用加热的方法将碘从其固态混合物中分离出来。
2.D 苯的同系物侧链上的取代反应条件是光照。
3.D 如果加入钠盐,溶液中增加了Na+这种杂质,显然选项 A,C 不符合题意。选项B 加入过量的SO42-,除去了杂质 Ba2+,而又引入杂质 SO42-。选选项B 加入过量的SO42-,除去了杂质 Ba2+,而又引入杂质 SO42-。选项D加入过量CO32-除去了杂质 Ba2+,过量的 CO32-又与 HNO3 反应,生成 CO2 气体而排出。达到了提纯的目的。
4.B 芒硝是水合硫酸钠晶体,要制取纯净的水合硫酸钠晶体首先要进行提纯,在此过程中要充分利用原料中的成分,并不能引入新的杂质。要除净Fe3+,加入的 NaOH 溶液要过量。滤去 Fe(OH)3 不溶物后用适量 H2SO4 溶液中和过量 NaOH ,得纯净 Na2SO4 溶液,浓缩结晶即可。
5.D 从题给信息:金属钠的密度为:0.97g/cm3,比苯的密度:0.88g/cm3大,但小于水的密度。故观察到的现象可能是:钠在苯与水的界面处反应并可能作上、下跳动。
6. B 分析喷洒在纸蝴蝶上的试剂与小烧杯中的溶液,石蕊为紫色,酚酞无色;浓盐酸和浓氨水有挥发性。
7.答:D 题目要求设计的实验装置在制气时,能够随开随用,随关随停,而所提供的仪器中没有长颈漏斗和双孔胶塞。根据题目提供的仪器,联想启普发生器或简易气体发生器的构造和工作原理,由 c和e组合可相当于启普发生器 "容器" 部分的上半部。实验时,块状大理石放在e的球形部分,e的上口用c塞紧。将e的下半部分放入酸溶液中,且使e中块状固体低于e外部酸液面。需要气体时,打开c导管处的弹簧夹,e 外部的酸液由e下口进入跟固体接触发生反应而产生二氧化碳。当不需要时,用弹簧夹夹住c导管上的橡胶管,反应暂时继续进行,而产生的气体不能导出,于是把 c 中的酸从下口压出,固液反应物脱离,,反应停止。这就达到了目的,在此基础上,在e的外面再配备盛酸的容器和能将e固定的装置。应选用的仪器是 a , c , d,e 。
8.B 这是一道信息题,利用给定的生活中常见的物质,鉴别食盐在存在着 IO3-。要充分理解、消化题目给定的知识—— IO3-可在酸性溶液中与I-发生反应,生成了I2单质,而鉴别I2的方法我们是知道的。
9.(1)H2 CH4 Cl2 SO2 (2)H2 CH4 NO A(3)B常规仪器或装置都有其主要用途,但并非唯一用途。(1)作集气装置,由A口进气为向上排空气收集比空气轻的气体:H2 CH4 ;由B口进气,为向下排空气收集比空气重的气体: Cl2 SO2 。 (2)若烧瓶内充满水,则为排水集气法,收集难溶于水的气体:H2 CH4 NO,应由 A口进入。 (3)若作为洗气瓶,则应“长进短出”,气体应从B口进入。
10. (1)第三步:向蒸馏烧瓶中放入几片碎瓷片缓慢加热
第四步:加热至65℃,收集馏出物
第五步:加热至78℃,收集馏出物
第六步:停止加热,待蒸馏烧瓶中的残液冷却后,向其中缓缓加入 18.4 mol/LH2SO4至过量,再加热至 118 ℃,收集馏出物。
(2)将乙酸中和生成乙酸钠,使乙酸乙酯在蒸
11. (1)避免和减少空气中的氧气对Fe(OH)2氧化 4Fe(OH)2+O2+2H20=4Fe(OH)3 溶入NaOH溶液的02,溶入FeSO4溶液的02,空气中的O2。
(2)方法一①稀H2SO4和铁屑 ②煮沸 ③避免生成的Fe(OH)2沉淀接触O2
(3)方法二:①稀H2SO4和铁屑 ②NaOH溶液 ③检验试管II出口处排出氢气的纯度。当排出的氢气纯净时,再夹紧止水夹 ④试管I中生成的H2充满了试管I和试管II,且外界空气不容易进入。
本题考查有三个侧重点:一是侧重考查考生解决问题的创新思维能力;二是侧重考查考生的语言文字表达能力;三是侧重考查考生的实验能力。题目设计巧妙,源于教材又高于教材。用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是高二教材重要的演示实验。方法一要求考生不但要知道怎样做该实验,还要求考生掌握为什么这样做?方法二设计制备Fe(OH)2的新方法,要求在制备过程中沉淀不转化,高于教材。Fe(OH)2、FeSO4均易被氧化,FeSO4又易水解。在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备白色Fe(OH)2沉淀,首先要排出大试管及稀H2SO4溶液与NaOH溶液中溶解的空气。
12. (1)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O向下排空气 碱石灰(2)打开止水夹,挤出胶头滴管中的水。氢气极易溶解于水,致使烧瓶内气体压强迅速减小。(3)D(4)C (5)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
2NH3↑+CaCl2+2H2O向下排空气 碱石灰(2)打开止水夹,挤出胶头滴管中的水。氢气极易溶解于水,致使烧瓶内气体压强迅速减小。(3)D(4)C (5)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
该实验以喷泉实验为背景命题,其中第(5)问,说明引发喷泉的方法,答案不唯一,是一道开放性实验题,(2)(3)(4)(5)问,源于教材,又高于教材,突出考察了运用基础知识和基本原理解决实验问题的能力。图1是教材中的原图,图2去掉了原有的胶头滴管,创设了新情境,要求考生在已经掌握了喷泉实验操作及实验原理的基础上,说明图2装置引发喷泉的实验方法,考生必须想出办法让氨气与水接触,问题才能迎刃而解。是考察逆向思维和创新精神的好题。
13. (1)N2、O2的体积(2)偏低 (3)酸性高锰酸钾或溴水 (4)V(SO2)=22.4CVa/(22.4CVa+Vb)
(5) bceg 或 beg 或 ceg
本题为信息型实验设计题,必须在接受有关信息的基础上,联系有关知识解决问题。信息1:混合气体中含有:SO2、N2、O2 ;信息2:N2、O2不与I2反应,SO2和I2发生反应为:SO2+I2+2H2O==H2SO4+2HI;旧知识:碘使淀粉显蓝色。(1)混合气体进入反应管后,SO2和I2发生反应,N2、O2不反应。故增加的水的体积等于N2、O2的体积。(2)反应管内溶液蓝色消失后,此时溶液中的I2已与SO2反应完全,继续通气,SO2气体也被排出,计入了N2和O2的体积,故测得的SO2含量偏低。(3)能与SO2反应且有颜色改变的均可代替碘的淀粉溶液。如:酸性高锰酸钾或溴水。
14. (1)向外轻轻拉动注射器的活塞;浸没在水中的玻璃导管口有气泡冒出;(2)蓝、无SO2+I2+2H2O=H2SO4+2HI
(3)
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| SO2含量/mg·m-3 | 0.53 | 0.46 |
三级:第一;抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差。
此装置的特殊性有两点:其一,除玻璃导管与大气相通外,注射器活塞可移动,若加热不便观察现象(注射器轻微移动不易看到);其二,橡胶管连有单向阀,抽气时,使空气通过玻璃导管进入试管与A溶液反应,推动注射器时,直管的单向阀关闭,残气从单向阀的支管排出。据此,只能拉动注射器直接检查气密性。