高三化学实验复习题(四)
华中师大一附中 汪兆龙
1.下列所设计的四种制备气体的方案中,不宜采用的是 ( )
①加热稀硫酸和乙醇制备乙烯 ②加热稀盐酸和MnO2制备氯气
③用稀硫酸和大理石制备碳酸气 ④用稀硝酸和硫化亚铁制备硫化氢
A.④② B.①②④ C.①③④ D.①②③④
2.某学生设计了如下四个实验方案,用以检验的水解程度,其中的操作和结论均正确的是 ( )
A.淀粉液![]() 水解液
水解液![]() 中性液
中性液![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解
B.淀粉液![]() 水解液
水解液![]() 碱性液
碱性液![]() 银镜
银镜
结论:淀粉水解完全
C.淀粉液 ![]() 水解液
水解液![]() 无银镜
无银镜
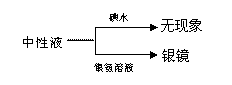 结论:淀粉尚未水解
结论:淀粉尚未水解
D.淀粉液![]() 水解液
水解液![]()
结论:淀粉完全水解
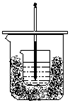 3.将50mL0.50mol·L-1盐酸与50mL0.55mol·L-1氢氧化钠溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可以计算出中和热。试回答下列问题:
3.将50mL0.50mol·L-1盐酸与50mL0.55mol·L-1氢氧化钠溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可以计算出中和热。试回答下列问题:
(1)从装置上看,尚缺少的一种玻璃用品是 ;
(2)烧杯间填满碎纸条的作用是 ;
(3)大烧杯上如不盖上硬纸板,求得的中和热 (填“偏大”、“偏小”或“无影响”);
(4)若实验中改用60mL0.50mol·L-1盐酸和50mL0.55mol·L-1氢氧化钠溶液进行,与上述实验相比,所放出的热量 (填“相等”或“不相等”);若用浓度和体积都相同的氨水代替氢氧化钠溶液进行实验,测得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
4.为了将混有硫酸钠和碳酸氢铵杂质的氯化钠提纯,并得到氯化钠溶液,
有人设计了如下实验:
请回答:
(1)在操作①完成的过程中,盛放药品的仪器名称是 ;
1
(2)操作②中能否选用其它试剂?试简述你的理由。
(3)操作③的目的是 ,
如何判断已达到此目的?
(4)你认为此实验设计是否严密?请说明理由或提出改进方案。
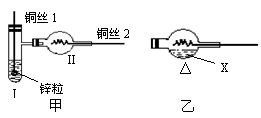
5.如图,用氢气还原氧化铜
的微型快速实验装置。实
验前先将铜丝1的下端弯
曲成一个小圆环,并用铁
锤击成一个带小孔的小匙,
将铜丝2的一端弯曲成螺丝状。
试回答下列问题:
(1)在试管Ⅰ中先加入的试剂是 ;
(2)操作铜丝2的方法是 ;
(3)实验现象是:Ⅰ Ⅱ
(4)这样处理铜丝2的优点是 ,
目的是 ;
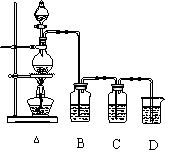 (5)某同学把图甲改成乙,容器内加入某种液体X,稍加热,铜丝操作的方法同铜丝2。若发现铜丝由黑变红,则液体X可能是
。
(5)某同学把图甲改成乙,容器内加入某种液体X,稍加热,铜丝操作的方法同铜丝2。若发现铜丝由黑变红,则液体X可能是
。
6.实验室可用碳酸钠合成亚硫酸氖晶体。
有关装置如下图所示。将17gNa2CO3溶
于80mL水中,分装在C、D两个锥形瓶
中,再将25g铜屑放入圆底烧瓶中,将
60mL浓H2SO4和10mL水的混合液装在
分液漏斗中,小心加热使SO2逐渐发生。
将SO2通入Na2CO3溶液中至饱和,在合
并C、D两瓶所得的溶液中,慢慢加入17gNa2CO3蒸发浓缩,冷却后得
到亚硫酸钠晶体,回答下列问题:
(1)配制60mL浓H2SO4和10mL水的混合液的操作是_______________;
(2)装置B中H2SO4的作用是___________________________________;
(3)Na2CO3溶液分装在两个锥形瓶中的原因是______________,所发生反应的化学方程式为_____________________________________;
(4)控制SO2产生速度快慢的方法是____________________________;
(5)通入气体结束后,再加入Na2CO3的目的是___________________。
2
7.为证明乙醇分子中含有氧原子,现采用一套装置进行试验,试根据以
下装置示意图、试剂及实验现象,回答有关问题。
Ⅰ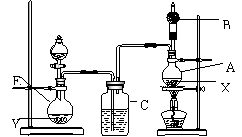 .装置中所装的试剂是:
.装置中所装的试剂是:
①A瓶装无水乙醇,内放无水 盐X
②B干燥管里装生石灰
③C和D中都装浓硫酸
④E瓶中装入试剂Y
Ⅱ.实验操作及现象是:
用水浴加热A瓶,将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,在B管口挥发的气体可点燃。
请回答下列各问:
⑴E瓶里所装的试剂Y是以下的________;
A.饱和食盐水 B.MnO2和NaCl的混合物 C.浓盐酸
⑵D中浓硫酸所起的作用是_________ ______,C瓶中浓硫酸所起的作用是__ ____________ ;
⑶A瓶中发生反应的化学方程式是______________________________,反应类型是_____________;所生成的___________(写名称)在B出口处点燃;
⑷无水盐X宜选用__________,它能起指示作用的原因是____________;
⑸此实验能验证乙醇分子中含有氧院子的理由是_________________;
⑹如果将装置中的C瓶去掉,实验目的是否能达到___________,因为___________________________________________________________;
8.乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种难溶于水的液体,它是有机
合成中常见的原料,在实验室里它可以直接用乙酸乙酯在乙醇钠的催
|
![]() 2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
2CH3COOC2H5 CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是金属钠和残留在乙酸乙酯中的微量乙醇作用生
成的。而一旦反应开始,生成的乙醇又与钠反应生成乙醇钠。阅读下
面关于乙酰乙酸乙酯制备的实验过程,并回答有问题。
⑴在干燥的圆底烧瓶中放入约5g金属钠(已用滤纸拭去表面的煤油)
和约35mL的二甲苯用胶塞塞好,加热使钠熔化,然后趁热摇振可得
到细粒的钠珠,目的为增大钠与乙醇的接触面积加快反应。其中加入
二甲苯的主要作用是______________,若用四氯化碳代替二甲苯是否
3
可行______ ,理由是____________________________。
⑵将烧瓶中的二甲苯小心倾出,迅速加入约55mL乙酸乙酯(约0.57mol),
装上带有一根长玻璃管的橡皮塞,并在玻璃管的上端接一干燥管,这
时开始缓缓加热,保持烧瓶中的混合物呈微沸状态,原因是
;
⑶待金属钠完全反应后,向烧瓶中加入约等体积的饱和食盐水,振荡后
静置,然后分离出乙酰乙酸乙酯。加入饱和食盐水的目的是
,分离出乙酰乙酸乙酯的
最主要的仪器名称是 ;
⑷向分离出的乙酰乙酸乙酯中加入无水硫酸钠固体,振荡后静置,然后
滤去残渣,最后将滤液减压蒸馏即可收集到产品约14g(0.1mol)。加
入无水硫酸钠固体的目的是 ,
实验最后所得产品远小于39g,你认为除了反应过程中的损耗外,主
要原因是 。
9.现有一定浓度的双氧水溶液、碘化钾溶液、淀粉溶液和蒸馏水等试剂,
请设计一个简单的实验来说明:与一定量的双氧水反应的碘化钾溶液
的浓度越大,反应速率就越快。要求:
(1)写出实验步骤
(2)设计实验表格,用来记录实验步骤和实验现象
(3)写出实验结论
4
化学实验复习(四)参考答案
1.D
2.D
3.(1)环形玻璃搅拌棒
(2)减少实验中热量的损失
(3)偏小 (4)相等、偏小
4.(1)坩埚 (2)可选用氢氧化钡。但是没有氯化钡好,因为加入氢氧化钡是引入了OH-,必须在操作③以后加入稀盐酸除去。
(3)除去过量的Ba2+。静置后取上方的清夜少许,往其中滴加几滴碳酸钠溶液,若没有浑浊现象出现就说明已经除净了Ba2+,否则就没有。
(4)不严密。因为在操作③中加入过量的碳酸钠溶液、过滤后加热并不能将过量的碳酸钠除去,应该在操作④之后逐滴滴入稀盐酸,将溶液的pH调节到7即可。
5.(1)稀盐酸或稀硫酸
(2)在Ⅰ中开始产生气泡时,将铜丝2在酒精等上加热至红热后迅速伸入到Ⅱ中
(3)锌粒不断溶解并产生气泡,红热的铜丝由黑变红
(4)形成铜锌原电池,产生H2速率快,并且随即停止;提高铜丝局部温度增大与氢气接触面积
(5)乙醇或氨水
6.(1)量取10mL的蒸馏水倒入一烧杯中,沿烧杯的内壁慢慢加入浓硫酸,同时用玻棒不断搅拌。
(2)干燥产生的SO2
![]() (3)充分吸收SO2 2SO2+Na2CO3+H2O
2NaHSO3+CO2
(3)充分吸收SO2 2SO2+Na2CO3+H2O
2NaHSO3+CO2
(4)观察洗气瓶中出现的气泡;用加热来控制反应的快慢,当气泡产生过快是可以暂时移走酒精灯,稍候再用小火加热
(5)将产生的NaHSO3溶液转化为Na2SO3
7.(1)C
![]() (2)吸收浓盐酸中的水分并放热使氯化氢气体逸出;干燥气体
(2)吸收浓盐酸中的水分并放热使氯化氢气体逸出;干燥气体
(3)CH3CH2OH+HCl CH3CH2Cl+H2O 取代反应 氯乙烷
(4)无水硫酸铜 实验中观察到无水硫酸铜由白色变成蓝色,说明反应中有水生成
(5)无水硫酸铜变蓝,证明了产物中一定有水,水中含有氧元素,它不可能来源于氯化氢,只能来源于乙醇
(6)不能 氯化氢挥发带出的水蒸气若不除去,就无法判断使无水硫酸铜变蓝的水的来源,也就不能确定氧元素的来源
8.(1)隔绝空气,防止钠被氧化;不可行;因为四氯化碳的密度比钠大,钠浮在液面上,仍然可以被氧化
(2)有水分时,钠以及乙醇钠都可以和水剧烈反应生成氢氧化钠,从而导致产物乙酰乙酸乙酯水解;冷凝回流;防止空气中的水蒸气进入到反应体系中
(3)使乙酰乙酸乙酯中的乙醇溶解于水,并且分层;分液漏斗
(4)除去乙酰乙酸乙酯中的水分;因为反应可逆,反应进行到一定发程度就达到了平衡,反应物不可能全部转化为生成物
9.(1)取2支试管;往第一支试管中加入双氧水溶液10mL、碘化钾溶液10mL;往第二支试管中加入双氧水溶液10mL、碘化钾溶液5mL、蒸馏水5mL;再向这两支试管中分别加入淀粉溶液5mL。
(2)表格为:
| 试管 | 双氧水溶液 | 碘化钾溶液 | 蒸馏水 | 淀粉溶液 | 现象 |
| 1 | 10mL | 10mL | 0 | 5mL | 先变蓝 |
| 2 | 10mL | 5mL | 5mL | 5mL | 后变蓝 |
(3)结论:溶液的浓度越大,化学反应速率就越快