高三化学单元练习
一、选择题(每小题只有1个正确选项)
1.固体熔化时必须破坏非极性共价键的是 ( )
A.冰 B.晶体硅 C.溴 D.二氧化碳
2.F2和Br2的沸点 ( )
A.前者高 B.后者高 C.相等 D.无法确定
3.金刚石和石墨两种晶体中,每个最小的碳环里所包含的碳原子数( )
A.前者多 B.后者多 C.相等 D.无法确定
4.氮化硅是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的粒子间作用力与氮化硅熔化时所克服的作用力相同的是 ( )
A.硝石和金刚石 B.晶体硅和水晶 C.冰和干冰 D.萘和碘
5.碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是 ( )
A.足球烯不可以发生加成反应
B.三者和氧气反应的最终产物不同
C.足球烯在苯中的溶解度比乙醇中溶解度大
D.石墨、足球烯均可作为生产耐高温润滑剂的原料
6.下列物质固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
7.下列晶体熔化时,化学键未被破坏的是 ( )
A.食盐 B.干冰 C.水晶 D.纯碱
8.萤石(CaF2)晶体属于立方晶系,萤石中Ca2+被8个F—所包围,则每个F—周围最近距离的Ca2+数目为 ( )
A.2 B.4 C.6 D.8
9.下列叙述正确的是 ( )
A.离子晶体都是化合物 B.原子晶体都是单质
C.晶体内部都存在共价键 D.金属都是金属晶体
10.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是―60.7℃,引起这种差异的主要原因是 ( )
A.范德瓦尔斯力 B.共价键 C.氢键 D.相对分子质量
11.首次提出胶体概念的科学家是[JIAOMU1] ( )
A.道尔顿 B.舍勒 C.格雷哈姆 D.丁达尔
12.下列分散系能发生丁达尔效应的是[JIAOMU2] ( )
A.CH3CH2OH水溶液 B.雾 C.纯净的空气 D.饱和食盐水
13.下列事实与胶体知识有关的是[JIAOMU3] ( )
① 用盐卤点豆腐;②用明矾净水; ③水泥的硬化; ④河海交界处易沉积成沙洲;⑤制肥皂时在高级脂肪酸钠、甘油和水形成的混合物中加入食盐析出肥皂
A.①②⑤ B.②③④ C.①③⑤ D.全部都是
14.下列变化属于物理变化的是[JIAOMU4] ( )
A.氧气在放电条件下变成臭氧
B.加热胆矾成白色固体
C.漂白的草帽久置于空气中变黄
D.氢氧化铁胶体中加入硫酸镁产生沉淀
15.已知土壤胶粒带负电荷,因此在水稻田里施用含氮量相同的下列化肥,肥效最差的是( )。
A.硫铵 B.氯化铵 C.碳铵 D.硝铵
16.向下列分散系中滴加稀硫酸,不会出现先生成沉淀,继续滴加稀硫酸后沉淀又溶解的现象的是( )
A.Na2SiO3溶液 B.Al(OH)3溶胶 C.Fe(OH)3溶胶 D.NaAlO2溶液
17.能区别溶液和胶体的方法是[JIAOMU5] ( )
A.静置,有沉淀现象的是胶体
B.有丁达尔效应的是胶体
C.能透过滤纸的是胶体
D.用肉眼观察,均匀透明的是溶液
18.在实验中手不慎被玻璃划破,可用FeCl3溶液紧急止血,其主要原因可能是( )。
A.FeCl3溶液溶液具有杀菌消毒的作用
B.FeCl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3溶液能使血液发生化学变化
二、选择题(每小题有1—2个正确选项)
1.下列纯净物所形成的晶体中,均为分子晶体的化合物组合为 ( )
A.C6H6、CO2、SiO2 B.D2O、SO3、PCl5、NaCl
C.C8H10、HD、NH3 D.H2SO4、P2O5、C3H8
2.干冰气化时,下列所述内容发生变化的是 ( )
A.分子内共价键 B.分子间的作用力
C.分子间的距离 D.分子内共价键的键长
3.AB、CD、EF均为1∶1型离子化合物,根据下列数据判断它们的熔点由高至低的顺序是 ( )
| AB | CD | EF | |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10—10) | 2.31 | 3.18 | 2.10 |
A.CD>AB>EF B.AB>EF>CD
C.AB>CD>EF D.EF>AB>CD
4.下列数据是对应物质的熔点(℃)
| 物质 | NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 熔点(℃) | 801 | 920 | 1291 | 190 | ―107 | 2073 | ―57 | 1723 |
据此作出的下列判断中错误的是 ( )
A.铝的化合物的晶体中有离子晶体
B.同族元素中的氧化物可形成不同类型的晶体
C.表中只有BCl3和干冰是分子晶体
D.不同元素的氧化物可形成相同类型的晶体
5.下列对物质熔、沸点变化规律的叙述不正确的是 ( )
A.同主族元素的单质,熔点都随原子序数的增加而升高
B.卤化物的沸点随原子序数的增加而升高
C.直链烷烃沸点随分子中的碳原子数增加而升高
D.低级饱和脂卤代烃的沸点随分子中碳原子数增加而升高
6.下列物质的熔沸点高低顺序中,正确的是 ( )
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>H2O>O2 D.金刚石>生铁>纯铁>钠
7.在NaCl晶体中,与每个Na+距离相等且距离最近的几个Cl—所围成的空间几何构型为 ( )
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
8.下列物质中,粒子间以共价键相互作用构成空间网状结构的晶体是( )
A.冰醋酸 B.干冰 C.食盐 D.二氧化硅
9.下列化学式既能表示物质的组成,又能表示物质分子式的是 ( )
A.NH4NO3 B.SiO2 C.C6H5NO2 D.Cu
10.目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中正确的是 ( )
A.是一种新型化合物 B.分子中只有一种共价键
C.是两种单质组成的混合物 D.相对分子质量为2400
11.用相同物质的量的下列物质使Fe(OH)3胶体凝聚,最好选用( )
A.碳酸钠 B.氯化镁 C.磷酸铵 D.氯化钙
12.下列关于胶体的叙述不正确的是[JIAOMU6] ( )
A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区分开来
B.光线透过胶体时,胶体发生丁达尔效应
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
13. 不能用有关胶体的知识解释的现象是( )。
A.在河流入海口处形成三角洲
B.在NaF溶液中滴入AgNO3溶液看不到沉淀
C.0.01 mol/L AgNO3 溶液中边振荡边滴入同浓度的NaI溶液,看不到黄色沉淀
D.同一支钢笔使用不同牌号的墨水易发生堵塞
14.将FeCl3饱和溶液逐滴滴入沸水中,制得Fe(OH)3胶体。为了除去其中所含有的盐酸,得到较纯净的Fe(OH)3胶体,应该采取得措施是( )
A.加入NaOH溶液进行中和
B.加入AgNO3溶液,反应后进行过滤
C.插入石墨电极,通入直流电进行电泳后再过滤
D.装入半透膜中,扎紧袋口,将其全部浸入蒸馏水中并每隔一定时间,更换一次蒸馏水 ,共2~3次
15.如果用(NH4)2SO4溶液培养植物,溶液的pH会( )
A.逐渐上升 B.逐渐下降 C.不变 D.无规律
16.下列有关胶体的说法正确的是( )
A.有丁达尔效应的透明溶液一定是胶体溶液
B.胶体分散系在电场中一定有电泳现象
C.因为Fe(OH)3胶体带正电,所以在电场作用下有电泳现象
D.不能穿过半透膜的微粒一定是胶体微粒
17.不能证明胶体微粒比溶液中溶质微粒直径大的实验是[JIAOMU7] ( )
A.电泳 B.丁达尔效应 C.布朗运动 D.渗析
18. 胶体微粒具有较强的吸附能力,是因为[JIAOMU8] ( )
A.带有相同电性的电荷 B.有很大的表面积
C.有很强的分散力 D.有电泳现象
19.已知由很稀的AgNO3溶液与过量很稀的KI溶液制得的AgI溶胶与Al(OH)3溶胶混合时,会析出AgI和Al(OH)3的混合沉淀,由此可知[JIAOMU9] ( )
A.该AgI胶粒带正电荷
B.该AgI胶粒电泳时向阳极移动并在阳极上析出沉淀
C.该AgI胶粒带负电荷
D.该Al(OH)3胶粒电泳时向阳极移动并在阳极上析出沉淀
20.有甲、乙、丙、丁和氢氧化铁五种胶体溶液,按甲和丙,乙和丁,丙和丁,乙和氢氧化铁胶体两两混合,均出现胶体凝聚,则胶体微粒带负电荷的胶体溶液是[JIAOMU10] ( )
A.甲 B.乙 C.丙 D.丁
21.已知硅酸胶粒带负电荷,对该胶体进行下列处理,不发生凝聚的是[JIAOMU11] ( )
A.加乙醛溶液 B.加入MgSO4溶液
C.对胶体加热 D.加Fe(OH)3胶体
22. Cu(OH)2溶胶做电泳实验时,阴极附近蓝色加深,往此胶体溶液中加入下列物质时,不产生凝聚的是( )
A.硫酸镁溶液 B.硅酸胶体溶液
C.氢氧化铁胶体溶液 D.葡萄糖溶液
班级_______ 学号_______ 姓名________ 成绩__________
一、选择题(每小题只有1个正确选项)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、选择题(每小题有1—2个正确选项)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
三、填空题
1.现有八种物质:①干冰;②金刚石;③晶体硫;④晶体硅;⑤过氧化钠;⑥二氧化硅;⑦溴化铵;⑧氖,请用编号填写下列空白。
⑴ 通过非极性键形成原子晶体的是__________________ ;
⑵ 固态时属于分子晶体的是 ______________ ;
⑶ 属于分子晶体,且分子为直线型的是_____________ ;
⑷ 由单原子分子构成的分子晶体是 ____________;
⑸ 含有非极性键的离子化合物是 ________________。
2.二氧化硅晶体中,每个硅原子周围有 ______个氧原子,每个氧原子周围有 _____个硅原子,硅、氧原子个数比为__________ 。
若去掉二氧化硅晶体中的氧原子,且把硅原子看作碳原子,则所得空间网状结构与金刚石空间网状结构相同,试推测每个硅原子与它周围的4个氧原子所形成的空间结构为 __________型;并推算二氧化硅晶体中最小的硅原子环上共有___________个原子。
3.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:
① 反应前的X与反应后生成的Z的物质的量之比n (X)∶n (Z) = 2∶3
② 单质Y的分子为正四面体构型。请填写下列空白。
⑴ 单质Y是______________,单质Z是__________(填写名称或分子式)。
⑵ Y分子中共含__________个共价键。
⑶ X分解为Y和Z的化学方程式为:_____________________________。
4.在Fe(OH)3胶体里加入2mol/L硫酸溶液,由于_______离子的作用,使胶体先形成了沉淀,这个过程称为____________;后来由于_______离子的作用,又使沉淀溶[JIAOMU12] 解。
5. 实验室制取Fe(OH)3胶体溶液的方法是__________________;用____________方法除去胶体中的浑浊;根据_____________现象证明胶体已经制成;用______________方法精制胶体;如何用实验方法证明胶体和Cl-两者已经分离______________________。
6.根据水源的情况来确定处理水的化学试剂,下列试剂中:(1)只能使水消毒的是______;(2)只能使水净化的是_________;(3)既能使水消毒,又能使水净化的是___________。
①Cl2;②NaClO;③Ca(ClO)2;④Ca(OH)2;⑤O3;⑥明矾溶液;
⑦Fe(OH)xCl(3-x);⑧Cl2和FeSO4
7.在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的问题。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9—10-7m之间,然后插入两根电极,接通直流电源,这时阳极聚集_________,阴极聚集________,理由_____________________。
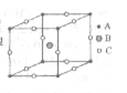
8.如下左图是一种离子晶体的晶胞,该离子晶体的化学式为___________。
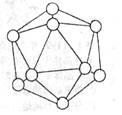
9.如上右图所示,晶体硼的基本结构单元都是由硼原子组成的正十二面体的原子晶体,其中含有20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试回答:
这个基本结构单元由________个硼原子组成,键角是______,共含有_____个B—B键。
四、计算题
已知LiI的晶体与NaCl晶体结构相同。实验测得Li+与I—最邻近的距离是0.302nm。假定I—和Li+都是刚性球。
⑴ 欲计算得到I—和Li+的近似半径时,你还必须在作什么假定?
⑵ 计算I—和Li+的近似半径;
⑶ 若用另一种方法测得Li+的半径约为0.060nm~0.068nm,试验证你的假定是否正确。
1.⑴ ②④;⑵ ①③⑧;⑶ ①;⑷ ⑧;⑸ ⑤。2.4 2 1∶2 正四面体 12 3.⑴ 白磷(或P4),氢气(或H2) ⑵ 6 ⑶ 4PH3 = P4 + 6H2 4.SO42-,聚沉,H+ 5. 在沸腾的蒸馏水中滴加饱和FeCl3溶液,待溶液呈红褐色,停止加热,即制得胶体;过滤;丁达尔现象;渗析;取半透膜外最后一次的溶液少许于试管中;加入AgNO3溶液;若无沉淀产生;证明两者已经分离。6. (1)①②⑤;(2)⑥;(3)③④⑦⑧ (说明:Ca2+、Fe(OH)3胶体、Al(OH)3胶体均能中和泥沙胶粒的负电荷,使水净化,ClO-、Cl2、OH-、O3、Fe3+等均能杀菌消毒)。7.带负电荷的陶土胶粒;带正电荷的氧化铁胶粒;带相反电荷的胶体微粒通电时产生电泳现象,分别向两极移动,从而达到除去陶土中氧化铁杂质的目的。8.ABC3 9. 12个硼原子,键角为60°,共含有B—B键30个。
⑴ 运用假设方法,从复杂的微观体系中抽象出数学模型。欲求得I—和Li+的近似半径,除假设I—和Li+是刚性球外,还需再假定两刚性球间彼此相切,这才将Li+和I—的距离看成是两离子半径之和。
⑵ 根据NaCl的晶体结构可建立如上述的一种“数学模型”。设其中r—表示I—半径,r+表示Li+半径,则有如下关系:
AC = 2(r+ + r—) ①
|
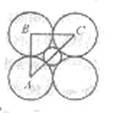
![]() =sin45° ②
=sin45° ②
|
![]() 由①②③式,得: =
0.414 ④
由①②③式,得: =
0.414 ④
又由假定知:r+ + r— = 0.302nm ⑤
④、⑤联立求解r+ = 0.088nm,r—= 0.214nm 图1—5
⑶ r+>0.060nm~0.068nm,说明可将Li+和I—看成刚性球但实际不相切。因为电子之间互相排斥,致使两离子半径之和小于它们之间的理论距离。
[JIAOMU1]A
[JIAOMU2]A
[JIAOMU3]D
[JIAOMU4]B
[JIAOMU5]B
[JIAOMU6]B
[JIAOMU7]A
[JIAOMU8]B
[JIAOMU9]BC
[JIAOMU10]BC
[JIAOMU11]A
[JIAOMU12]SO42-;胶体的凝聚;H+;