高三化学第二次统考2
可能用到的相对原子质量:H:1 Na:23 Mg:24 Al:27 C:12 O:16 S:32 Cl:35.5 Br:80
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案)
1.下列叙述错误的是
A.室温时,零族元素的单质都是气体
B.所有主族元素的原子形成单质离子时的化合价和它族序数相等
C.过氧化钠晶体中含有离子键和共价键
D.某晶体中含有金属阳离子,不一定含有阴离子
2.在0℃ 1.01×105Pa下,体积相同的下列四组物质,分子数相同的一组是
A.CH3Cl、CH2Cl2 B.SO2、CO2 C.SO3、PCl3 D.CH4、CCl4
3.关于氯水的叙述正确的是
A.氯水中只含Cl2和H2O分子
B.新制的氯水可使红色石蕊试纸先变蓝后腿色
C.光照氯水有气泡冒出,该气体是Cl2
D.氯水放置数天后,pH值变小,几乎无漂白性
4.原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是
A.4Z B.4Z+10 C.4Z+5 D.4Z+14
5.某种亚硫酸钠样品14g,露置一段时间后,质量变为14.8g(假设干燥物结晶水),则14.8g固体中Na2SO4质量为
A.7.1g B.7.4g C.8.0g D.6.4g
6.下列晶体熔化时化学键没有被破坏的是
A.氯化钠 B.水晶 C.磷酸 D.金刚石
7.下列各组物质熔点由高到低的是
A.SiO2>MgO>金刚石 B.CsCl>KCl>NaCl
C.Ca>Mg>Na D.CO2>H2O>H2S
8.氯元素有质量为35和37的同位素,现测得氯元素的近似相对原子量为35.5,则同位素37Cl在氯元素中的质量分数为
A.24% B.25% C.26% D.75%
9.下列每组物质发生状态变化所克服的微粒间的相互作用属于同种类的是
A.钠和硫熔化 B.二氧化硅和氧化钠熔化
C.碘和干冰升华 D.食盐和蔗糖熔化
10.A与B都是短周期元素,原子半径B>A,它们可以形成AB2,由此可得出的不正确判断是
A.A与B可能是同一周期 B.A一定在B的前一周期
C.A可能是金属元素 D.A一定在第二周期的ⅡA或ⅣA
11.能用磨口玻璃塞保存的试剂有
|
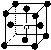
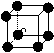
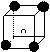
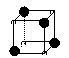 12.有下列离子晶体的空间结构示意图,以M代表阳离子,以N代表阴离子, 阳离子,·阴离子,化学式为MN3的晶体结构为
12.有下列离子晶体的空间结构示意图,以M代表阳离子,以N代表阴离子, 阳离子,·阴离子,化学式为MN3的晶体结构为
A B C D
13.同周期的三种元素X、Y、Z,已知它们的最高价含氧酸的酸性又强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列叙述不正确的是
A.非金属性X>Y>Z B.X、Y、Z形成阴离子的还原性逐渐增强
C.原子半径X>Y>Z D.X、Y、Z的气态氢化物稳定性由强到弱
14.24mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
15.下列微粒为正四面体构型的离子是
A.P4(白磷) B.H3O+ C.CH3Cl D.NH4+
16.下列物质中各原子不是“八电子”稳定结构的是
A.CO2 B.PCl5 C.Na2O D.COCl2
二、填空题(本题共14分)
17.(4分)化工行业已合成一种硬度比金刚石还大的晶体氮化碳,若已知氮在化合物中显-3价,推断:
⑴其化学式可能是_____________;⑵其晶体类型是_____________;
⑶你认为其硬度比金刚石大的主要原因是________________________________________________________________________________________。
18.(4分)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染中的一种新的方法:第一步使用Na2SO3的水溶液吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3.同时得到高浓度SO2的水溶液副产品,写出上述两步反应的化学方程式:
①_________________________________________________
②___________________________________________________
19.(6分)在白磷分子中,每个磷原子以________键与另外的_______个磷原子相结合成___________结构,键角为_____。如果把一个白磷分子的每个P-P都打开插入一个氧原子,则一共可结合____个氧原子,这样得到此化合物的分子式为__________。
三、推断题(共21分)
20.有A、B、C、D四种单质,在一定条件下,B可以分别和 A、C、D化合生成化合物甲、乙、丙。D和C化合生成化合物丁。已知甲、乙、丙的每个分子中分别含有10个电子,且甲、乙、丙、丁有如下关系:
乙+A=甲+C C+丙 丁+乙 请填写:
⑴单质B的化学式:________________________________
⑵单质A和化合物乙发生反应的化学方程式:__________________________
⑶写出C和D化合生成物质丁的化学方程式:____________________________
⑷根据化合物丙、丁中元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D,若能写出化学方程式:______________________________。若不能请说出理由:____________________________________________________________________。
21.已知A、B分别为两种盐,I为金属单质,J为空气中一主要成分的单质,根据下列框图变化,推断:AgNO3+HCl==AgCl↓+HNO3
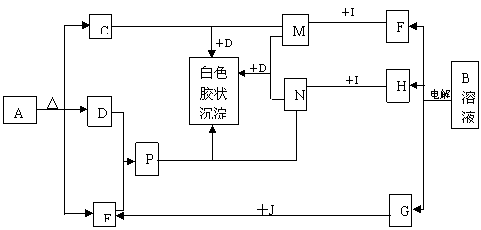
⑴写出下列物质的化学式:A____ B_____ F______ H_____G______
⑵写出C的分子构型_________ D的结构式_____________
E的电子式__________ 分子构型_______________
⑶写出下列反应的离子方程式:
①M+N+D![]() 白色胶状沉淀:__________________________________
白色胶状沉淀:__________________________________
 ②P+N
②P+N![]() 白色胶状沉淀:______________________________________
白色胶状沉淀:______________________________________
四、实验题(19分)
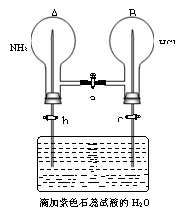
22.如图所示:若要让两烧瓶都出现美丽的喷泉,应先________,
现象___________________________________,
发生反应的化学方程式:_____________________________________;
然后关闭________________,打开___________________,
现象:A瓶________________,B瓶_________________,
原因:___________________________________________
_________________________________________________。
23.(9分)有一瓶部分氧化变质的亚硫酸钠,为了测定其纯度,
其实验操作可分解为如下几步:A溶解;B加入稍过量的氯化钡溶液;C过滤;D洗涤沉淀;E加入稍过量的盐酸;F烘干;G称量。就此实验完成填空:
⑴正确操作的步骤顺序是(用序号字母填空)_______________________________;
⑵将氯化钡溶液加入样品溶液中时,怎样判断沉淀是否完全__________________________________________________________________________________________;
⑶D步骤操作的目的是____________________________________________,
检验沉淀是否洗净的方法是_______________________________________________________________________________________________________________________。
⑷若称量样品质量为ag,实验过程中所得沉淀烘干后质量为bg,则原样品的纯度是________;被氧化的Na2SO3的质量分数为_______________;
⑸假若试样中的原物质已有50变质,若a=10g,则b为__________。
答案:1B 2B 3D 4C 5A 6C 7D 8C 9C 10A 11B 12D 13C 14B 15D 16B
17.⑴C4N3 ⑵原子晶体 ⑶N原子半径小于C原子半径,C-N键长比C-O键长短,C-N键的键能大,故硬度更大。
18.①SO2+Na2SO3+H2O==2NaHSO3 ②2NaHSO3![]() Na2SO3+SO2↑+H2O
Na2SO3+SO2↑+H2O
19.共价键、3、四面体、60、6、P4O6
20.⑴H2 ⑵2H2O+2F2==4HF+O2↑ ⑶N2+O2==2NO ⑷ 4NH3+6NO==5N2+6H2O
21.⑴A:NH4HCO3或(NH4)2CO3 B:NaCl F:NaOH H:Cl2 G:H2
⑵略 ⑶①Al3++3AlO2-+6H2O==4Al(OH)3↓ ② 3NH3·H2O+Al3+==Al(OH)3↓+3NH4+
22.先打开a;瓶内都出现白烟;NH3+HCl==NH4Cl;a;b、c;
出现蓝色喷泉;出现红色喷泉;当打开活塞a时,NH3和HCl反应
生成 NH4Cl固体,两瓶内气体压强急剧下降(或减少),故形成喷泉。
23。⑴GAEBCDFG ⑵向滤液中加入BaCl2溶液,无沉淀证明沉淀完全 ⑶除去沉淀表面吸附有可溶性杂质;取最后洗涤液加AgNO3看是否有白色沉淀。 ⑷×100% ×100% ⑸8.2g