高三化学第二次统考
一、选择题(每小题只有一个选项正确)
1.下列颜色变化不涉及化学变化的是:C
A.Na2O2表面变白 B.KI溶液变黄 C.白色NaCl固体灼烧火焰呈黄色
D.AgI由黄变黑
2.同温、同压下,两个容积相同的集气瓶,一个装有C2H4,另一个装有CH4和C3H4的混合气体,两瓶气体一定具有相同的:D
A.质量 B.原子总数 C.密度 D.氢原子数
3.ClO2是一种广普型的消毒剂,它氧化性强,消毒效率高,且不跟水中的有机物发生取代和加成反应。根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水消毒剂。工业上常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得ClO2,在以上反应中氧化剂和还原剂的物质的量之比为:C
A.1:1 B.1:2 C.2:1 D.3:2
4.向NaBr、NaI、Na2SO3混合液中通入过量Cl2后,将溶液蒸干并充分灼烧,得到固体剩余物的组成可能是:B
A.NaCl B.NaCl、Na2SO4 C.NaCl、NaBr、Na2SO4
D.NaCl、Na2SO4、I2
5.下列离子方程式中正确的是:D
 A.过量的NaHCO3与Ba(OH)2溶液反应:Ba2++OH-+HCO3-=BaCO3↓+H2O
A.过量的NaHCO3与Ba(OH)2溶液反应:Ba2++OH-+HCO3-=BaCO3↓+H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.漂白粉溶液中通入过量CO2:ClO-+CO2+H2O=HCO3-+HClO
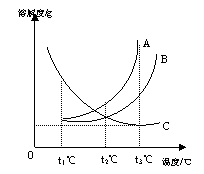
6.t3℃时,将A、B、C三种固体物质分别溶于100g水中,刚好都制成
饱和溶液(三种物质均不与水反应)。图时它们的溶解度曲线,以下对
这三种溶质的说法正确地是:A
A.t3℃时,C溶液溶质的质量分数最小
B.t3℃ 时A溶液的物质的量浓度最大
C.t2℃时,B、C两溶液溶质的质量分数相等
D.t1℃时,A、B两溶液溶质的质量分数相等,C溶液溶质的质量分数最大
7.设NA表示阿伏加得罗常数,下列叙述正确的是:D
A.1molH2O中含有的电子数约为10NA
B.2.4g金属镁变为镁离子时失去的电子数为0.1NA
C.1.8g重水(D2O)中含中子数为NA
D.常温、常压下1molO3含有的氧原子数为3NA
8.在烧杯中加入水和煤油各50ml,将一小粒金属钠投入烧杯中,观察到的现象可能是:D
A.钠在水层中反应并四处游动 B.钠停留在煤油层中不发生反应
C.钠在煤油液面上反应并四处游动 D.钠在煤油与水的交界处反应并可能上、下跳动
9.现以纯碱、石灰石、水等为原料制取氢氧化钠溶液,过程中没有涉及到的反应类型有:C
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.下列离子组能够大量共存的是:A
A.K+、AlO2-、NO3-、OH- B.H3O+、NO3-、Na+、Fe2+
C.Al3+、Na+、HCO3-、SO42- D.Fe3+、K+、Cl-、SCN-
11.将10mL 1mol·L-1的CuSO4溶液与10mL 1mol·L-1的NaOH溶液混合,生成蓝色沉淀,假如溶液中c(Cu2+)、c(OH-)都已变得很小,可忽略,则生成的沉淀的化学式可表示为:B
A.Cu(OH)2 B.Cu2(OH)2SO4 C.CuSO4·2Cu(OH)2 D.Cu2O
12.一定条件下,mg下列物质在足量O2中充分燃烧,产物用过量的Na2O2完全吸收后,Na2O2固体增重mg,符合此要求的组合是:①H2 ②CO ③H2和CO ④HCHO ⑤CH3OH ⑥HCOOCH3 D
A.除⑥外 B.①②③ C.④⑤⑥ D.全部
13.标况下,A容器中的SO2和B容器中的SO3含有相同的氧原子数,则两容器中两种氧化物的体积比:D
A.1:1 B.2:3 C.3:2 D.凭题中条件难以判断
14.对某酸性溶液(可能含有:Br-、SO42-、H2SO3、NH4+)分别进行如下实验:①加热产生使品红退色的气体;②加足量NaOH溶液后加热放出使湿润的红色石蕊试纸变蓝的气体;③加入氯水时,溶液呈黄色,再加入BaCl2溶液,产生的白色沉淀不容于硝酸。对于下列物质不能确认在溶液中是否存在的是:B
A.Br- B.SO42- C.NH4+ D.H2SO3
15.在医院中,为酸中毒的病人输液,不因采用:B
A.0.9%NaCl溶液 B.0.9%NH4Cl溶液 C.1.25%碳酸氢钠溶液
D.5%葡萄糖溶液
16.若以ω1和ω2分别表示浓度为amol·L-1和bmol·L-1氨水的质量分数,且知2a=b,氨水的密度比纯水小,则下列推断正确的是:D
A.2ω1=ω2 B.2ω2=ω1 C.ω1<ω2< 2ω1 D.ω2>2ω1
二、(本题包括2小题,共20分)
17.(8分)用18.4mol·L-1的浓H2SO4配制100mL 1mol·L-1的稀H2SO4。
⑴配制上述溶液需要量取浓H2SO4的体积为__________mL。
⑵配制溶液过程中,除量筒、烧杯、玻璃棒、胶头滴管外,还要用到的玻璃仪器有_____________,该仪器上有哪些标记____________。
⑶下列配制的操作,不会影响所配制溶液浓度大小的是_____________。
A.洗涤烧杯和玻璃棒的溶液转入容量瓶 B.定容时,眼睛仰视刻度线
C.容量瓶内水未干便注入溶液 D.定好容,塞好瓶塞反复摇匀后静置,发现凹液面低于刻度线
18.(12分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:①NH3+CO2+H2O==NH4HCO3 ②_______________________________________________。
将所得碳酸氢钠晶体加热分解后即可得到纯碱,请填写方程式②并回答:
⑴工业所制纯碱中常含有少量的杂质,请问最有可能含有的杂质是________________。
⑵现有甲、乙两个小组的学生,为了测定工业纯碱样品中的Na2CO3的质量分数,分别设计并完成实验如下:
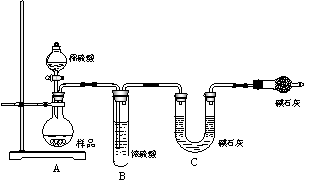 甲组:取10.00g样品,利用图示的装置,测出反应
甲组:取10.00g样品,利用图示的装置,测出反应
后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,向其中加入过量的盐酸,直至
样品中无气泡冒出,加热蒸发所得物并在干燥管中冷
却至室温后称重。反复加热、冷却、称重,直至所称
的固体质量几乎不变为止,此时所得固体的质量为:
10.99g。请分析、计算后填写下表。
|
分组 | 计算样品中碳酸钠的质量分数 | 对实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲组 | 失败 | ||
| 乙组 | 成功 |
三、
19.(1O分)⑴过氧化氢可作为采矿业废液消毒剂,如要消除废液中的氰化物,化学反应式(已配平)为:
KCN+H2O2+H2O== A +NH3↑①生成物A的化学式为__________②反应中______元素被氧化。
⑵赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将两者混合加热有以下反应发生:Cu2S+2Cu2O![]() 6Cu+SO2↑①在该反应中,还原剂是____________氧化剂是________。
6Cu+SO2↑①在该反应中,还原剂是____________氧化剂是________。
②还原产物与氧化产物的物质的量之比为____________________。
20.(6分)在25℃、101kPa下,1g丁烷(C4H10)完全燃烧生成二氧化碳和液态水时放出热量50kJ,试写出体现丁烷燃烧热的热化学方程式:_________________________________________;
已知1mol液态水气化时需吸收44kJ热量,则1mol丁烷完全燃烧生成气态水时放出的热量为_______。
四、
21.(4分)麻醉剂的发现和使用是人类医疗史上了不起的一项成就,它可使患者在接受治疗时感受不到疼痛。⑴笑气(N2O)是一类最早用于医疗的麻醉剂之一,它可由NH4NO3晶体在微热时分解产生,产物除笑气外还有一种,此反应的方程式为___________________________________(标出电子转移的方向和数目)。
⑵另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒光气(COCl2):2CHCl3+O2![]() 2COCl2+2HCl,为了防止事故,使用前可用于检验氯仿是否变质的试剂是________。
2COCl2+2HCl,为了防止事故,使用前可用于检验氯仿是否变质的试剂是________。
A.淀粉-碘化钾溶液 B.NaOH溶液
C.酚酞溶液 D.AgNO3溶液
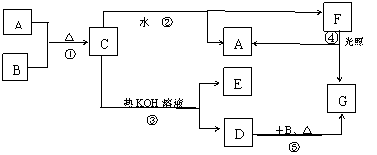 22.(10分)图中每方框内字母表示有关的一种反应物或生产物,(生成C时的其它产物或其它反应中生成的水已略去),其中A、F为酸,D、E为盐,C、G为气体。
22.(10分)图中每方框内字母表示有关的一种反应物或生产物,(生成C时的其它产物或其它反应中生成的水已略去),其中A、F为酸,D、E为盐,C、G为气体。
据此回答下列问题:
⑴写出相应物质的化学式:
D____________;G__________。
⑵写出F的电子式______________
⑶写出相应反应的化学方程式:
反应①_________________________________
反应②__________________________________。
五、
23.(4分)15.6g Na2X含有0.4molNa+,Na2X的摩尔质量为_______,X的相对原子质量为_________________。
24.(8分)将8.2g的NaHCO3与NaOH的混合物放在密闭容器中加热到300℃,充分反应后排出气体,剩余固体残渣为7.3g。
⑴固体残渣的成分是_________
A.Na2CO3与NaOH B.Na2CO3与NaHCO3 C.只含Na2CO3 D.只含NaOH E .Na2CO3、NaHCO3与NaOH
⑵计算原混合物中NaHCO3与NaOH的物质的量之比?
答案:
17.⑴5.4 ⑵容量瓶(100mL);刻度线、温度、容积。 ⑶A、C、D
18.②NaCl+NH4HCO3==NaHCO3+NH4Cl ⑴NaCl ⑵84.8%;CO2滞留在装置中,没有被C中碱石灰完全吸收,造成结果偏; 95.4%
19.⑴①KHCO3 ②C(碳) ⑵①Cu2S;Cu2S、Cu2O ②6:1
![]() 20.C4H10(g)+O2(g)==4CO2(g)+5H2O(l);△H=-2900kJ·mol-1。2680
20.C4H10(g)+O2(g)==4CO2(g)+5H2O(l);△H=-2900kJ·mol-1。2680
![]() 21.⑴NH4NO2
21.⑴NH4NO2![]() N2O+2H2O ⑵D
N2O+2H2O ⑵D
![]() 22.⑴KClO3;O2 ⑵
⑶①MnO2+4HCl(浓)
22.⑴KClO3;O2 ⑵
⑶①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
③3Cl2+6KOH![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
23. 78g·mol-1,32
25. ⑴A ⑵NaHCO3+NaOH![]() Na2CO3+H2O(g) Δm
Na2CO3+H2O(g) Δm
124 18g
8.2g Δm、=1.2g>0.9g
说明NaOH过量,先计算NaHCO3
== ∴x=4.2g
m(NaOH)=8.2g-4.2g=4.0g
=:=1:2