高三化学第二次月考化学卷
相对原子质量:Na-23 O-16 Fe-56 Ag-108 I-127 C-12 N-14 Ba-137
一、选择题(每题只有一个选项正确)
1、大气或饮用水被污染时,可能引起人的牙齿骨骼变酥,引起这一污染的元素是( )
A、I B、F C、Cl D、S
2、国家卫生组织宣布,到2000年要消除碘缺乏病,为此,食盐必须是国家统一标准的加碘盐,你认为加碘是指在(盐)NaCl中加( )
A、碘单质 B、碘化钠 C、碘酸钾 D、次碘酸钾
3、市面上销售的金首饰是否属于纯金,可取样品与某试剂进行反应,据现象即可判断,该试剂是( )
A、盐酸 B、硝酸 C、王水 D、硫酸
4、铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是( )
A、NaCl B、K2SO4 C、FeCl2 D、KNO3
5、下列离子方程式书写正确的是( )
A、碳酸钠溶液中逐滴加入等物质的量的乙酸
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B、二氧化硫通入NaClO溶液中:
SO2+H2O+2ClO-=SO32-+2HClO
C、用碳棒作电极电解氯化钠饱和溶液
2Cl-+2H2O===2OH-+H2↑+Cl2↑
D、碳酸钡溶于氢氟酸
BaCO3+2H+=Ba2++H2O+CO2↑
6、甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失。丁溶液滴入甲溶液时,无明显发生。据此可推断丙物质是( )
A、Al2(SO4)3 B、NaOH C、Bacl2 D、 FeSO4
7、将4.3克Na、Na2O、Na2O2的混合物与足量的水充分反应后,在标准状况下得到672mL混合气体,将该混合气体通过放电,恰好完全反应,则它们的物质的量之比为( )
A、1:1:1 B、1:1:2 C、1:2:1 D、4:3:2
8、此题有两小题
工业上制备CuCl2时,是将浓HCl用蒸气加热至80℃左右,慢慢加入粗制CuO粉(含杂质FeO),充分搅拌,使之溶解。已知:PH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;PH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;PH为3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
①为除去溶液中的Fe2+,可以采用的方法是( )
A、直接加强碱,调整PH≥7.6 B、加铜粉,使Fe2+还原出来
C、先将Fe2+氧化成Fe3+,再调整PH为3—4 D、通入H2S,使Fe2+直接沉淀
②若此溶液只含Fe3+时,再调整PH在3—4,此时最好向溶液中加入( )
A、NaOH B、氨水 C、CuCl2 D、CuCO3
9、某未知液可能含NaOH、Na2CO3、NaHCO3中的一种或两种物质,现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定。当达到滴定终点,消耗盐酸的体积分别为V1ml和V2ml。如果V1<V2<2V1,则上述溶液中的溶质是( )
A、NaHCO3 B、Na2CO3 C、Na2CO3、NaHCO3 D、NaOH、Na2CO3
10、为了使鱼苗顺利运输,必须满足三个条件:①需要保持适量的氧气②使鱼苗呼出的二氧化碳及时排出③防止细菌大量繁殖。已知下述四种物质加入水中都可起到供氧灭菌作用,其中过氧化钙极难溶于水。在长距离运输鱼苗的水中,最好加入( )
A、过氧化钠 B、氯水 C、过氧化钙 D、双氧水
11、FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比21:8,则混合物中FeO、Fe2O3和Fe3O4的物质的量之比不可能是( )
A、2:2:1 B、2:1:1 C、1:1:1 D、2:2:5
12、0.1mol Na2O2、Na2O的混合物溶于水后,刚好被100g7.3%的盐酸中和。则混合物中Na2O2和Na2O的物质的量之比为( )
A、1:1 B、2:1 C、任意比 D、3:4
13、有5.1g镁、铝合金,投入500ml2mol.L-盐酸溶液中,金属全都溶解后,再加入4mol.L-1氢氧化钠溶液,若要达到沉淀最大值,则加入氢氧化钠溶液的体积应为( )
A、250mL B、425mL C、500mL D、560mL
14、氯仿(CHCl3)可用作麻醉剂,但常因保存不慎而被空气氧化,产生光气
2CHCl3+O2=2HCl+2COCl2(光气) 光气有剧毒,为防止事故发生,用以检验氯仿是否变质的试剂是( )
A、澄清石灰水 B、硝酸银溶液 C、氢氧化钠溶液 D、漂白粉溶液
15、向KI溶液中加入AgNO3溶液,直到反应完全为止。如果反应后溶液的质量恰好等于原碘化钾溶液的质量,则该AgNO3溶液中溶质的质量分数为( )
A、38.2% B、48.8% C、50% D、72.3%
二、填空题
16、某无色溶液中含有Na+、SO42-、SO32-、CO32-、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:
①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生。试回答:
1)原溶液中肯定存在的离子是 ,肯定没有的离子是
2)若步骤③改用BaCl2和盐酸的混合溶液,对判断①结论有无影响?
3)步骤②中发生反应的离子方程式为
17、钢铁在中性或弱酸性环境中发生 腐蚀,正极反应式为
18、某化工生产中,要用到一种无色可溶于水的晶体——铝铵矾。该晶体是一种复盐,其主要化学成分为十二水硫酸铝铵。向该复盐的浓溶液中加入NaoH溶液,将发生一系列变化。
已知:NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2-+H2O=Al(OH)3↓+NH3↑
试回答:
1)硫酸铝铵在水溶液中电离方程式
2)在逐滴加入浓NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀量逐渐减少
那么,各种现象由先到后出现的顺序是
3)写出滴入NaOH溶液的过程中,有关离子方程式
a、
b、
c、
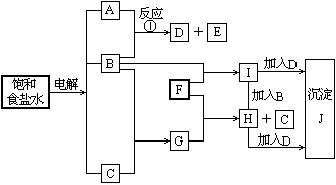 |
19、下面框图中每一个方格表示的一种反应物或生成物(反应时加入或生成的水,以及生成沉淀J时其他产物均已略去)
填写下列空白:
1)物质B是 ,F是 ,J是
2)反应①的离子方程式是
20、长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量ag样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解;
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液;
④过滤,用蒸馏水洗涤沉淀;
⑤加热干燥沉淀物
⑥将沉淀物冷却至室温后,称量;
⑦重复⑤⑥操作直到合格,最后得到bg固体;
试回答:
1)本实验中是否能用Ba(NO3)2代替BaCl2? ,其理由是
2)步骤③中加盐酸溶液呈强酸性的目的是
3)步骤⑦的合格标准是
4)实验测得样品中无水亚硫酸钠的质量分数是
(列出算式,不需化简)
三、计算题
21、27.2g铁粉和氧化铁的混合物放入500mL的稀H2SO4中,发现固体完全溶解,并放出0.2g氢气,此时无Fe3+,然后向溶液中加入2mol/L的NaOH溶液,当溶液呈中性时,用掉NaOH500mL,求原H2SO4的物质的量浓度。
22、某校研究性学习课外环保监测小组对采集气体样品中所含污染气CO的浓度进行测定,其方法与步骤如下:a、首先使采集的气体样品2.00L缓缓通过I2O5的加热管,发生反应:CO+I2O5→CO2+I2 b、将产生的I2升华,并由浓度为0.005mol.L-1的Na2S2O3溶液30.0mL完全吸收,此时发生反应:
I2+S2O32-→I-+S4O62- c、向b的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01mol.L-1的I2水滴定,耗去5.00mL的溶液恰好变色。
①操作C中,滴定终点时溶液由 色边为 色
②步骤a中由CO与I2O5反应生成I2的物质的量是多少摩?
③该气体样品中CO的浓度为多少mg/L?
 高三化学第二次月答卷
高三化学第二次月答卷
一、选择题(每题只有一个选项正确) 48分
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | ||
二、填空题
16、(8分)①
②
③
17、(3分)
18、(10分)①
②
③a b
c
19、(8分)①物质B是 ,F是 ,J是
②反应①的离子方程式是
20、(9分)①
②
③
④
三、计算题(14分)
21、(6分)
22、(8分)
参考答案:
1B2C3B4D5C6D7D8①C②D9D10C11B12C13A14B15D
16(1)Na+、Br-、SO32-;CO32-(2)无;(3)Cl2+2Br-=Br2+2Cl-;Cl2+SO32-+H2O=SO42-+2Cl-+2H+
17吸氧;O2+2H2O+4e-=4OH-;18(1)NH4Al(SO4)2=NH4-+Al3++2SO42-(2)①③②⑤④(3)Al3++3OH-=Al(OH)3;NH4-+OH-=NH3↑+H2O;Al(OH)3+OH-=AlO2-+2H2O
19、(1)Cl2(或氯气),Fe(或铁),Fe(OH)3(或氢氧化铁)(2)Cl2+2OH-=ClO-+Cl-+H2O
20(1)不能;NO3-在酸性条件下会将SO32-氧化成SO42-(2)保证都是硫酸钡沉淀,没有亚硫酸钡沉淀(3)前后两次称量的质量差小于0.1g
(3)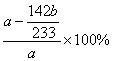
21、1mol/L
22、(1)无色、蓝色(2)2.5*10-5mol(3)1.75mg/L