高三化学第一学期期中考试试题2
可能用到的原子量:
H1 Be 9 C 12 N 14 O 16 Na 23
Li 7 Al 27 S32 Cl35.5 Zn 65 Fe 56
第Ⅰ卷 选择题(共72分)
一、单项选择题(每小题4分,共32分)
1、经过“普九”工程后,校园环境有了较大的改善,垂柳飘飘,绿树葱葱,花儿片片,坐在教室里不时传来阵阵花香,花香这种现象说明( )
A.分子很大 B.分子分裂成原子 C.分子在不停运动 D.分子间有间距
2、不久前,欧洲的一个科学小组在德国达姆塔特通过实验,由![]() Ni和
Ni和![]() Pb经核聚合,并紧接着射出一个中子而获得第110号元素的一种同位素(元素符号暂用X),该同位素是( )
Pb经核聚合,并紧接着射出一个中子而获得第110号元素的一种同位素(元素符号暂用X),该同位素是( )
A. ![]() X
B.
X
B. ![]()
![]() X
C.
X
C. ![]() X D.
X D. ![]() X
X
3、A元素的阴离子An-跟B元素的阳离子Bn+具有相同的电子层结构,以下叙述中正确的是( )
①原子半径A>B ②离子半径A>B
③原子序数A<B ④最外层电子数A>B
⑤A的负化合价与B的正化合价绝对值相等
A.①② B.③④⑤ C.②③④⑤ D.都对
4、下列各组物质气化或熔化时,所克服微粒间的作用属于同类型的是
A.冰和干冰 B.二氧化硅和二氧化碳
C.钠和氯化钠 D.氯化铵和碘
5、已知在25℃、101kPa条件下,1克C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l) + 25/2O2(g) = 8CO2(g) + 9H2O(g) ; △H =-48.40kJ/mol
B.C8H18(l) + 25/2O2(g) = 8CO2(g) + 9H2O(l) ; △H =-5518kJ/mol
C.C8H18(l) + 25/2O2(g) = 8CO2(g) + 9H2O(l) ; △H =+5518kJ/mol
D.C8H18(l) + 25/2O2(g) = 8CO2(g) + 9H2O(l) ; △H =-48.40kJ/mol
6、以石墨作电极,电解CuSO4溶液,若阳极上析出氧气8g,则此时在阴极上析出铜的质量是( )
A.8g
B.16g C.32g D.64g
7、类推的思维方式在化学学习与研究中有时会产生错误的结论,因此,类推出的结论最终要经过实践的验证才能决定其正确与否。以下类推的结论正确的是( )
A、Na、Al具有强还原性,Na常温下与水剧烈反应,故Al也是
B、CO2是直线型非极性分子,故CS2、SiO2也是
C、实验室用浓硫酸与食盐共热得到HCl气体,故用浓磷酸也可以
D、由2Fe+3Cl2===2FeCl3可推出2Fe+3I2===2FeI3成立
8、下列离子方程式正确的是( )
A.过量的NaHSO4与Ba(OH)2溶液反应:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 ↓+ 2H2O
B.NH4HCO3溶液与足量的氢氧化钠溶液反应:
NH4+ + OH- == NH3↑ + H2O
C.碳酸镁溶于硝酸中:
CO32- + 2H+ = CO2↑ + H2O
D.FeBr2溶液中通入过量氯气:
2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
二、选择题(每小题4分,有1-2个正确选项,正确但不全者可以得2分,共40分)
9、根据中学化学教材所附的元素周期表判断,下列叙述不正确的是( )
A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子数为奇数的所有元素所在族的序数与该元素原子的M层电子数相
10、把3摩尔A和2.5摩尔B混合于2升的容器中,发生如下反应:3A(气)+B(气)==2D(气)+XC(气),经5分钟后达到平衡生成1摩尔D,经测定C的平均反应速度为0.1摩/升·分,下列叙述中错误的是( )
A.B的转化率为20%
B.X值是1
C.A的平均反应速度是0.15摩/升·分
D.B的平衡浓度为0.5摩/升
11、设NA代表阿伏加德罗常数,下列说法正确的是
A.11.7g食盐晶体中的分子数为0.2NA
B.0℃压强为1.01×105帕时,22.4升SO3含分子数为NA
C.常温、常压下,1摩尔甲烷气体含有原子数为5NA
D.1摩尔铵根离子所含的质子数为11NA
12、下列各溶液中能大量共存的离子组是:
A.使pH试纸呈深红色的溶液中:Fe2+、SO42-、I-、NO3-
B.C(H+)=10-14mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-
C.pH=3的溶液中:Mg2+、Fe3+、Cu2+、SO42-
D.使紫色石蕊试液变红色的溶液中:K+、Na+、Ca2+、HCO3-
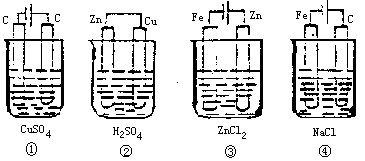 13、在下边四种装置中,溶液的体积相同,开始时电解质溶液的浓度均为0.10mol· L-1,工作一段时间后,测得导线上均能通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是:
13、在下边四种装置中,溶液的体积相同,开始时电解质溶液的浓度均为0.10mol· L-1,工作一段时间后,测得导线上均能通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是:
A.溶液的pH值:④>③>①>②
B.电解质溶液总体积:④=③=②=①
C.产生气体总体积:④>③>①>② D.电极上析出的固体质:①>②>③>④
14、同温、同压下同体积的A 、B 两种气体或蒸气的质量比为23:16,当B的分子量为32 时,则A 的分子式不可能是( )
① C2H6O ② CH2O2 ③ 气态烷烃 ④ N2O
A.①、② B.①、③ C.②、③ D.③、④
15、膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,存在于电石气的杂质中。它的分子成三角锥形。以下有关PH3的叙述正确的是
A.PH3是非极性分子 B.PH3分子中有未成键电子
C.PH3是一种强氧化剂 D.PH3分子中的P-H键是非极性键
16、根据:S2O82- + 2e- = 2SO42-
Mn2+ + 4H2O = MnO4- + 8H+ + 5e-
推断氧化1.5molMn2+需要S2O82-的物质的量为( )
A.1.5mol B.3.75 mol C.3.25 mol D.3.125 mol
17、不久前,美国加州海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供电和蒸汽,其工作温度为600-700℃,所用燃料为氢气,电解质为熔融的K2CO3,已知该电池的总反应为:2H2 + O2 = 2H2O 负极反应式为:H2 + CO32- - 2e- = H2O + CO2,则下列推断正确的是( )
A.正极反应式为:4OH- - 4e- = 2H2O + O2 ↑
B.放电时CO32-向负极方向移动
C.电池供应1mol水蒸气,转移电子为4mol
D.放电时CO32-向负极正向移动
18、往100mLFeBr2溶液中缓慢通入2.24L(标准状况)氯气,反应完全后溶液中有1/3的溴离子被氧化成溴单质,则该FeBr2 溶液的物质的量浓度为(不考虑氯气与水的反应) ( )
A.0.1mol/L B.2.0 mol/L C.1.2 mol/L D.2.4 mol/L
![]() 第Ⅱ卷 非选择题(共78分)
第Ⅱ卷 非选择题(共78分)
三、(本题包括两小题,共22分)
 19(10分)W、X、Y、Z四种短周期元素的原子序数X > W > Z > Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子最外层电子数是次外层电子数的2倍。Z和W可形成W2Z和W2Z2两种化合物。
19(10分)W、X、Y、Z四种短周期元素的原子序数X > W > Z > Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子最外层电子数是次外层电子数的2倍。Z和W可形成W2Z和W2Z2两种化合物。
(1) 四种元素原子半径从大到小的顺序为_______________________(填元素符号)
(2) W、X元素的最高价氧化物对应的水化物的碱性________强于__________
(填化学式)
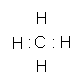
(3) Y所形成的气态氢化物分子的电子式为__________,是由_______键构成的_______性分子,其最高价氧化物分子的结构式是_____________。
(4)
 W单质在Z单质中燃烧所得生成物的电子式为_______________。
W单质在Z单质中燃烧所得生成物的电子式为_______________。
20(12分)A.B.C是短周期ⅠA和ⅡA族元素的碳酸盐,他们的质量分别为mA、mB、mC,与足量的盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。已知:mA = mB + mC , nA(HCl) = nB(HCl) + nC(HCl).请填空:
(1) 写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐(正盐)的名称 _________________________________________。
(2)若以MA、MB、MC分别表示A、B、C的相对分子质量,试写出MA、MB、MC三者的关系式_______________________________________________。
 (3)A的正确选择有_____种,其化学式为___________________________。
(3)A的正确选择有_____种,其化学式为___________________________。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次为_____________________,mB :mC = ________。(保留2位小数)
四、(本题包括2小题,共19分)
21(9分)用一种试剂除去杂质(括号内物质),写出所用试剂的化学式及反应的离子方程式。
(1) CO2(HCl):试剂是____________________________,离子方程式为________________________ 。
(2) FeCl2(FeCl3): 试剂是________________________,离子方程式为_______________ _。
(3) N0(NO2): 试剂是____________________________,离子方程式为______________________ _。
22(10分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子的催化下可以发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式:
____________________________________________________。
(2)此反应的氧化剂是_______,氧化产物是__________。
(3) 此反应的离子方程式可表示为:_________________________________。
(4)若将该反应所用的硫酸锰改为氯化锰(MnCl2),当它跟过量的过硫酸钾反应时, 除有高锰酸钾、硫酸钾和硫酸生成外,还有__________生成。
 五、(本题包括2小题,共20分)
五、(本题包括2小题,共20分)
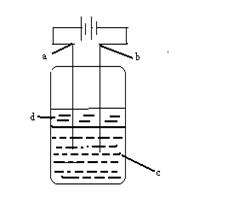
23、(12分)由于Fe(OH)2极易被氧化,所以实
验室很难用亚铁盐和烧碱反应制得白色纯净
的Fe(OH)2沉淀,应用右图所示方法可制得
白色纯净的Fe(OH)2沉淀,两电极材料分
别是石墨和铁。
(1)a极材料应为________,a电极的电极反应式为
_____________________________________________。
(2)电解液c可以是(填字母)___________
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_______________________________________,在加入苯之前,对c溶液应作何简单处理____________________________
________________________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是___________。
A、改用稀硫酸作电解质溶液
B、适当增大电源的电压
C、适当减小两电极间的距离
D、适当降低电解液的浓度
24、(8分)人类最早使用的火药是黑火药,它是1500年前我国古代炼丹家发明的,它的使用对于促进世界进步有着深远的意义。黑火药爆炸时发生的反应主要为:(未配平)
(1)配平:____KNO3 + ___S + ___C = ___K2S + ___CO2↑ + ___N2↑
(2)1mol氢气燃烧时约放出286kJ的热量,而每千克汽油燃烧放热46000kJ,氢气被公认为21世纪替代矿物燃料的理想能源。试简述氢气作为能源时的三个主要优点:
①________________________________________________,
②____________________________________ ,
③__________________________________________ 。
六、(本题包括2小题,共17分)
25、(7分)已知A和B两元素的单质气体在同温同压下能以体积比2:1完全化合成C气体,且反应后的气体体积比反应前的气体体积减小1/3。通过计算证明B元素的单质一定不是单原子分子。
26、(9分)相对原子质量大于10的两种元素X、Y,能形成两种化合物A、B。已知A分子中X和Y原子个数比为1:2,A在标准状况下的密度为2.86
g•L-1;又知B分子中有一个X原子,B对氧气的相对密度为2.5。推算:
(1) X和Y两元素的名称
(2) A和B的分子式。
答案:1.C 2.B 3.C 4.A 5.B 6.C 7.C 8.A
9.C 10.BD 11.CD 12.BC 13.B 14.D 15.B 16.B 17.B 18.C
19. (1) Na > Mg > C > O
(2) NaOH Mg(OH)2
![]()
![]()
 (3)
,极性共价 非极性 0=C=O
(3)
,极性共价 非极性 0=C=O
‥‥
(4) Na+[:O:O:]2-Na+
‥‥
20.(1)碳酸钠、碳酸镁、碳酸锂、碳酸铍
(2)MB 〉MA 〉MC 或 MC 〉MA 〉MB
(3)2 MgCO3 Li2CO3
(4)MgCO3、BeCO3、Na2CO3 1.05:1
21.(1)NaHCO3 HCO3- + H+ = H2O + CO2 ↑
(2)Fe Fe + 2Fe3+ = 3Fe2+
(3)H2O 3NO2 + H2O = 2NO3- + NO↑ + 2H+
22.(1)2MnSO4 + 5K2S2O8 + 8H20 = 8H2SO4 + 2KMnO4 + 4K2SO4
(2)K2S2O8 KMnO4
(3)2Mn2+ + 5S2O82- + 8H20 = 16H+ + 2MnO4- + 10SO42-
(4)Cl2
23.(1)铁 Fe–2e- = Fe2+
(2)B、C
(3)隔绝空气 加热煮沸以赶净溶解的氧气
(4)B、C
24.(1)2 1 3 1 3 1
(2)① 原料来源丰富 ② 燃烧产物无污染 ③ 单位质量的氢气
燃烧时放出的热量大。
25.略
26.(1)硫、氧 (2)SO2 SO3