高三化学电离平衡
一、选择题
1.在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+ 浓度减小,可采用的方法是
A 加热 B 加入0.1mol/L 的醋酸溶液100mL
C 加入少量的0.5mol/L的硫酸 D 加入少量的1mol/L 的NaOH溶液
2.下列溶液肯定是酸性的是
A 含H+的溶液 B 加酚酞显无色的溶液
C pH<7的溶液 D [OH-]<[H+]的溶液
3.下列叙述正确的是
A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B 溶液中[H+]越大,pH值也越大,溶液的酸性就越强
C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
4.在25℃时,某稀溶液中由水电离产生的[H+]=10-13mol/L。下列有关该溶液的叙述正确的是
A 该溶液一定呈酸性 B 该溶液一定呈碱性
C 该溶液的pH值可能为1 D 该溶液的pH值可能为13
5.下列溶液中,pH>8的是
A 0.1mol/L氨水跟0.1mol/L盐酸等体积混合后的溶液
B 将pH=12的NaOH溶液稀释至100倍后所得到的溶液
C 将pH=5的醋酸溶液稀释至10000倍后所得到的溶液
D [OH-]=10-6mol/L的NaOH溶液10mL加入浓度10-5mol/L的NaOH溶液100mL后的溶液
6.在相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,α表示水的电离度,则能使α/Kw值增大的是
A Na2CO3 B NaHSO4 C NaOH D AI2(SO4)3
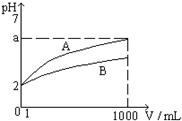
7.25℃时将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的是
8.某种0.1mol/L的一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则有关反应后溶液的判断中一定正确的是
A、![]() B、
B、![]()
C、若反应生成的MA不水解,则C(A-)>C(OH-) D、若反应生成的MA水解,则C(A-)<C(OH-)
9.pH=9的Ba(OH)2溶液与pH=12的KOH溶液按4:1的体积比混合,则混合溶液中的氢离子浓度为(单位为mol·L-1)
A、![]() B、
B、![]()
C、![]() D、
D、![]()
10.等量的NaOH分别用pH=2和pH=3的醋酸中和,消耗二者的体积依次为Va和Vb,则Va,Vb的关系为
A、Va=10Vb B、Va<10Vb C、Va>Vb D、Vb>10Va
11.常温下某溶液中,水电离出的c(OH-)=10-5mol/L,该溶液中的溶质可能是
A.Al2(SO4)3 B.CH3COONa C.NaOH D.NaHSO4
12.pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,充分反应后,收集H2的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下列说法正确的是
A.HX一定弱酸 B.HY一定是强酸
C.HX的酸性强于HY的酸性 D.反应开始时二者生成H2的速率相同
13.浓度都是0.2mol/L的盐酸(甲)和醋酸溶液(乙)各50mL,分别加入等体积的0.1mol/L的烧碱溶液。以下关于反应后甲、乙两杯溶液的说明,错误的是
A.甲溶液的pH在1~2之间 B.甲溶液的pH较乙小
C.甲溶液的pH较乙大 D.乙溶液的pH仍然小于7
14.在滴入甲基橙试剂的50mL0.05mol/L的一元强酸溶液中,滴入0.1mol/L的烧碱溶液,当滴至橙色刚好变为黄色时,所用烧碱溶液的体积为
A.大于25mL B.等于25mL C.小于25mL D.无法确定
15.已知酸性强弱顺序为:H2A>H2B>HA->HB-,下列化学方程式正确的是
A.NaHB+H2A=H2B+NaHA B.Na2B+H2A=H2B+Na2A
C.H2B+Na2A=NaHB+NaHA D.H2B+NaHA=NaHB+H2A
16.pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,混合液的pH为
A. 7.2 B.8 C. 6 D.无法计算
17.室温时,若0.1mol·L-i的一元弱碱的电离度为1%,则下列说法正确的是
A.该溶液的pH=11
B.该溶液的pH=3
C.加入等体积0.1mol·L-iHCl后所得溶液的pH=7
D.加入等体积0.1mol·L-iHCl后所得溶液的pH>7
18.25℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=12,酸碱溶液混合后溶液的pH=7,则酸溶液的体积(V1)与碱溶液的体积(V2)的关系是
A.V1=102V2 B.V2=102V1 C. V1=2V2 D. V2=2V1
|
|
19.pH = 2的A、B两种酸溶液各1mL, 分别加水稀释到1000mL, 其溶液的pH与溶液体积(V)的关系如右图所示, 则下列说法正确的是
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a = 5时, A是强酸, B是弱酸
D.若A、B都是弱酸, 则5 > a > 2
20.取pH=4的某电解质溶液1.0L,用Pt电极进行电解,经过一段时间后,测得溶液pH=1,且阴、阳两极产物的物质的量之比为2:1,则该电解质溶液是
A. 盐酸 B.氢氧化钾溶液 C.硝酸银溶液 D.硫酸铜溶液
21.在室温条件下,酸和碱的溶液等体积混合后,pH值一定大于7的是
A pH=3的盐酸和pH=11的氢氧化钡溶液
B pH=3的醋酸(电离度约为1%)和pH=12的氢氧化钠溶液
C pH=3的硝酸和pH=11的氨水(电离度约为1%)
D pH=3的硫酸和pH=12的氢氧化钾溶液
22.四种水溶液①HCI,②FeCI3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离度依次为α1、α2、α3、α4,则它们的关系正确的是
A.α1=α2=α3=α4 B.α1>α3>α2>α4
C.α4=α2>α3=α1 D.α1=α3>α2=α4
23.已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸的碱盐
24.下面的各说法中正确的是
A.在1000C时,纯水中的pH=6,呈中性
B.pH=5的稀醋酸,再加水冲稀100倍,溶液的pH=7
C.0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3 :1
D.在Na3PO4溶液中c(Na+) :c(PO43-)=3 :1
25.向一定体积的0.1摩/升的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是
A.溶液的pH值变小 B.醋酸的电离度增大
C.溶液的导电能力减弱 D.中和此溶液所需的0.1摩/升NaOH溶液的体积增加
26.下列溶液,一定呈中性的是
A 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B [H+]=1×10-7mol·L-1 的溶液 C pH=14-pOH 的溶液 D pH=pOH 的溶液
27.若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
A.10(a+b-12)% B.10(a+b-14)% C.10(12-a-b)% D.10(14-a-b)%
28.PH=13的强碱溶液与PH=2的强酸溶液混和,所得混和液的PH值=11,则强酸与强碱的体积比是
A.11:1 B.9:1 C.1:11 D.1:9
29.在pH值都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为A摩/升与B摩/升,则A和B关系为
A .A>B B .A=10-4 B C. B=10-4 A D. A=B
二、填空简答
30. 25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
(3)a的取值范围是_______________________________________。
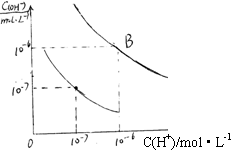 31.水的电离平衡曲线如右图所示:
31.水的电离平衡曲线如右图所示:
(1)若以A点表示25℃时水电离平衡时的离子浓度,B点表示100℃时水的电离平衡状态,则此时水的离子积从 ,增加到 。
![]() (2)将pH=8的Ba(OH)2溶液与pH=5的盐酸溶液混合,并保持100℃,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
。
(2)将pH=8的Ba(OH)2溶液与pH=5的盐酸溶液混合,并保持100℃,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为
。
32.某温度(t℃)时,水的Kw =10-13 ,则该温度(填大于、小于或等于) 25℃,其理由是 。将此温度下 pH =11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,
(1)若所得混合液为中性,则a : b ;
(2)若所得混合液的 pH == 2,则 a : b ;
33.某温度下纯水的[H+]=2.0×10-7mol/L。在此温度下,某溶液中由水电离出
的[H+]为4.0×10-13mol/L,则该溶液的pH值可能是____________。
34.现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH值=11
的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组
溶液pH值的大小:(Ⅰ)组________,(Ⅱ)组___________。
35. PH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,恰好反应生成正盐,混合溶液的pH=8。
(1)反应生成正盐的化学式为 。
(2)该盐中 离子(填离子符号)一定能水解,其水解的离子方程式为 。
36.在25℃时,有pH=a的盐酸与pH=b的NaOH溶液,取VaL该盐酸同该NaOH溶液恰好反应,需VbLNaOH溶液,问:
(1)若a+b=14时,则Va/Vb= (填数值);
(2)若a+b=13时,则Va/Vb= (填数值);
(3)若a+b>14时,则Va/Vb= 表达式),且Va Vb(填>、<或=)。
37.向50mL0.018mol/L的AgNO3溶液中,加入50mL0.02mol/L的盐酸,生成了沉淀。如果溶液中[Ag+]、[Cl-]的乘积是一个常数:[Ag+][Cl-]=1.0×10-10,求:
(1)沉淀生成后溶液中[Ag+]是多少?
(2)沉淀生成后溶液的pH值是多少?
电离平衡答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| D | D | D | CD | BD | AD | AC | AC | D | D | AB | AD | CD | C | AC |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | |
| C | A | A | CD | D | CD | C | B | A | BC | D | A | D | B |
30、(1)否,此时另一种也呈酸性
(2)否,此时Va将大于Vb
(3)3.5<a<14/3
31、10-14 ,10-12;2:9
32、大于,因水的电离吸热
(1)10:1 (2)9:2
33、12.4或1
34、醋酸大于盐酸,氨水大于氢氧化钠
35、(1)BnAm
(2) An- An-+H2O![]() HA(n-1)-+OH-
HA(n-1)-+OH-
36、(1)1
(2)0.1
(3)10a+b-14 ,大于
37、(1)1.0×10-7mol/L
(2)2