高三[电化学] 测试卷
可能用到的相对原子质量:Na23,H1,O16,Cl35.5,Ag108,N14,Cu64
一、选择题(只有一个正确答案,每题3分,共30分)[把选择题答案写在背面的方框中]
1、(1997年)钢铁发生吸氧腐蚀时,正极上发生的电极反应是
(A)2H++2e- =H2 (B)Fe2++2e- =Fe
(C)2H2O+O2+4e-=4OH- (D)Fe3++e-=Fe2+
2、电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质是
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
3、(1998年)将质量分数为0.052(5.2%)的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是:
| NaOH的质量分数 | 阳极析出物的质量(克) | 阴极析出物的质量(克) | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
4、用铂作电极电解某金属氯化物MCln的水溶液,当阳极产生amol气体时,阴极析出mg金属,则金属的相对原子质量是:
A.2ma/n B.2na/m C.mn/2a D.an/m
5、(2000年)下列关于实验现象的描述不正确的是:
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
6、(1991年)用两支惰性电极插入500毫升AgNO3溶液中,通电电解.当电解液的pH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是:
(A)27毫克 (B)54毫克 (C)108毫克 (D)216毫克
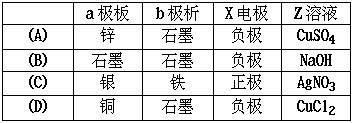 | 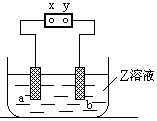 | ||
7、(1993年)右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
8、(1996年)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
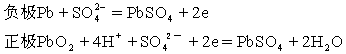
今若制得Cl20.050摩,这时电池内消耗的H2SO4的物质的量至少是:
(A)0.025摩 (B)0.050摩 (C)0.10摩 (D)0.20摩
9、(1992年)用石墨作电极,电解1摩/升下列物质的溶液,溶液的pH值保持不变的是:
(A)HCl (B)NaOH (C)Na2SO4 (D)NaCl
10、(1992年三南)A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为:
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解
②电解摩尔浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)
(A)A>B>C (B)B>C>A (C)C>A>B (D)B>A>C
二、选择题(有一或两个正确答案,每题4分,共20分。)
11、(2000广东)用铂电极(情性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是:
A.稀NaOH溶液 B.HCl溶液
C.酸性MgSO4溶液 D.酸性AgNO3
12、(2001上海)铜片和锌片用导线连接后插入稀硫酸中,锌片是:
A 阴极 B 正极 C 阳极 D 负极
13、(2002广东)在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是:
(A) 原电池的正极和电解池的阳极所发生的反应
(B) 原电池的正极和电解池的阴极所发生的反应
(C) 原电池的负极和电解池的阳极所发生的反应
(D) 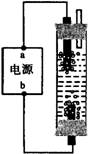 原电池的负极和电解池的阴极所发生的反应
原电池的负极和电解池的阴极所发生的反应
14、(2002上海)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是:
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
15、(2002春招)通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是:
A 在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1
B 在两个阳极上得到的产物的物质的量不相等
C 硝酸亚汞的分子式为HgNO3 D 硝酸亚汞的分子式为Hg2(NO3)2
二、填空题:(凡是反应式均2分,其它空格均1分,共34分)
16、如图所示,如果导线不连接,则只有 棒与硫酸反应放出 氢气,方程式为:
;连接导线后灯泡亮,证明装置中产生了电流。这就构成一个原电池。其中锌极的反应是:
;它是电池的 极;铜棒本身 参加反应,只是锌棒失去的电子沿导线流过来,堆积到铜棒表面,然后,溶液中的 在铜棒的表面上得到电子,反应式是:
;现象是铜棒表面上也产生了气泡。总反应式是:
。结论:活泼的金属失去电子,作为电池的 极。
氢气,方程式为:
;连接导线后灯泡亮,证明装置中产生了电流。这就构成一个原电池。其中锌极的反应是:
;它是电池的 极;铜棒本身 参加反应,只是锌棒失去的电子沿导线流过来,堆积到铜棒表面,然后,溶液中的 在铜棒的表面上得到电子,反应式是:
;现象是铜棒表面上也产生了气泡。总反应式是:
。结论:活泼的金属失去电子,作为电池的 极。
17使用碳棒作电极电解氯化铜溶液,阴极反应是: ;阳极反应是: ;总反应是: 。如果想要把电解后的溶液还原到电解前的组成,则可以在此中加入适量的 。
18、(2000江西)下图每一方框中的字母代表一种反应物或生成物:
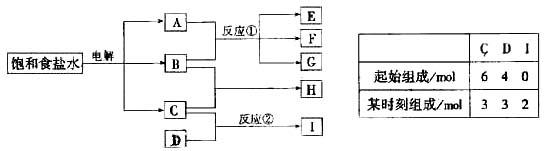
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
 (1)、物质H的分子式是___________。
(1)、物质H的分子式是___________。
(2)、反应①的化学方程式是____________________。
反应②的化学方程式(须注明反应条件)是_____________ 。
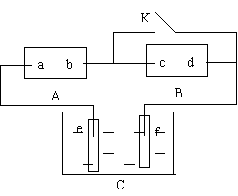
19、(2002试测)右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或 (只要求填两种电解质溶液)。
三、简答题:(第20题4分,第21题6分,共10分)
20、现有盛放饱和氯化钠溶液、U形管、酚酞试液、PH试纸、6mol/L的盐酸、2mol/LnaOH溶液、两根石墨电极和导线。简述如何利用以上仪器和药品,通过一个简单实验来确定某一个蓄电池的正负极。
21、请你设计出一个装置,在该装置内金属铜能与稀硫酸反应生成氢气和硫酸铜,即:
Cu + H2SO4(稀) == CuSO4 + H2↑
要求:画出示意图,注明有关部件的名称,同时写出相关的反应式。
四:计算题:(6分)
22、用惰性电极电解2L 1mol/L的硝酸铜溶液,当某一电极增重6.4g时,求溶液中氢离子(H+)的物质的量浓度是多少?(电解时溶液体积变化忽略不计)。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
参考答案:
1C2B3B4C5C6B7A8C9C10D11AC12D13BC14B15D
16、锌;Zn+H2SO4=ZnSO4+H2;Zn-2e-=Zn2+;负;不;H+;2H++2e-=H2;Zn+H2SO4=ZnSO4+H2;负
17、Cu2++2e-=Cu;2Cl—2e-=Cl2;CuCl2=Cu+Cl2;氯化铜;
18(1)HCl
(2)Cl2+2NaOH==NaCl+NaClO+H2O
N2+3H2 ![]() 2NH3(化学方程式1分,反应条件1分)
2NH3(化学方程式1分,反应条件1分)
19、(1)正 (2)2NaCl+2H2O=H2↑+Cl2↑+2NaOH
(3)Zn-2e- = Zn2+, Zn2++2e- = Zn,ZnSO4溶液或ZnCl2溶液
20、在U形管加入适量的滴有酚酞的饱和食盐水,用导线把两支石墨棒与蓄电池的两极相连并对上述食盐水进行电解,通电一段时间后,有一个石墨电极附近的溶液变成红色,则与这个电极相连的是蓄电池的负极,另一个是正极。
21、用铜作阳极,硫酸作电解液的电解池。图略。
22、0.1mol/L